|
Avaliação clínica, radiográfica e ultrassonográfica precoce da osteoartrose induzida em coelhos e tratados com concentrado autólogo de plaquetas*
Esteban Osorio-Carmona1
This email address is being protected from spambots. You need JavaScript enabled to view it.
1 Doutorado em Medicina e Cirurgia Veterinária, Universidade Federal de Minas Gerais. Belo Horizonte, Brasil. 2 Mestre em Ciência Animal, Universidade Federal de Minas Gerais. Belo Horizonte Brasil. 3 Departamento de Clínica e Cirurgia Veterinária, Universidade Federal de Minas Gerais. Belo Horizonte, Brasil. 4 Programa de Iniciação Científica da Escola de Veterinária, Universidade Federal de Minas Gerais. Belo Horizonte, Brasil.
Recibido: 14 de septiembre de 2016 y Aprobado: 17 de abril de 2017, Actualizado: 21 de diciembre de 2017
DOI: 10.17151/vetzo.2018.12.1.4
RESUMO: O objetivo desta pesquisa foi avaliar, por meio de exames clínicos, radiográficos e ultrassonográficos o efeito do concentrado autólogo de plaquetas (CAP) na osteoartrose (OA) induzida na articulação fêmoro-tíbio-patelar (FTP). Foram empregados 14 coelhos machos, adultos, com massa corporal média de 3,0 kg, da raça Nova Zelândia nos quais foi induzida a OA no membro posterior direito (MPD). Os coelhos foram divididos aleatoriamente em dois grupos constituindo o grupo controle e o grupo CAP. Os animais do grupo controle receberam 0,5 ml de Ringer Lactato intra-articular. O grupo CAP recebeu imediatamente após a reparação do ligamento cruzado cranial 0,5 ml de CAP intra-articular, cuja concentração média de plaquetas foi de 1,8 vezes os níveis basais. Estas injeções foram realizadas imediatamente após a estabilização articular. Os coelhos tratados com CAP apresentaram scores clínicos significativamente melhores (p<0,05) quando comparados com os coelhos do grupo controle em relação à sensibilidade dolorosa, presença de efusão articular e apoio do membro 15 dias após a aplicação do CAP (M3). A amplitude de movimento articular mostrou diferença estatisticamente significativa (p<0,05) na flexão e extensão do MPD no M3 em ambos os grupos. As imagens radiográficas e ultrassonográficas mostraram presença de processo articular degenerativo em ambos os grupos sem diferença estatística entre eles. Dos resultados pode-se concluir que o CAP tem efeito clínico benéfico em articulações acometidas pela OA, favorecendo o uso do membro e controlando a sensibilidade dolorosa, e que a radiografia e a ultrassonografia são ferramentas úteis na avaliação da progressão da OA.
Palavras chave: processo articular degenerativo, diagnóstico por imagem, terapia regenerativa, plasma rico em plaquetas.
Early clinical, radiographic and ultrasonographic evaluation of induced osteoarthritis in rabbits treated with autologous platelet concentrate
ABSTRACT: The objective of this study was to evaluate, the early effect of the autologous platelet concentrates (APC) on induced osteoarthritis (OA) in the stifle joint through clinical, radiographic and ultrasonographic exams. Fourteen adult males of the New Zealand breed rabbits, with an average body mass of 3.0 kg were used to induce OA in the right hind limb (RHL). Rabbits were randomly divided into two groups, control group and APC group. Animals in the control group received 0.5 ml intra-articular Ringer Lactate solution. Immediately after the repair of the cranial cruciate ligament, the APC group received 0.5 ml APC intra-articular injections whose mean concentration of platelets was1.8 times the basal levels. Intra-articular injections were applied immediately after joint stabilization. Rabbits treated with APC showed significantly better clinical scores (p<0.05) when compared with rabbits in the control group in relation to pain sensitivity, joint effusion presence and limb support 15 days after APC application (M3). The range of limb motion showed statistically significant difference (p<0.05) in flexion and extension of RHL in M3 in both groups. The radiographic and ultrassonographic images showed the presence of degenerative joint process in both groups without statistical difference between them. From the results it can be concluded that APC has a beneficial clinical effect in joints affected by OA, favoring the use of the limb and controlling pain sensitivity, and that radiography and ultrasonography images are successful tools in the evaluation of the progression of OA.
Key words: degenerative joint process, diagnostic imaging, regenerative therapy, platelet rich plasma.
Introdução
As doenças ortopédicas, especialmente as articulares, representam uma grande percentagem na rotina dos hospitais veterinários e podem acometer animais de qualquer idade ou sexo (Tatarunas et al., 2004). A ruptura do ligamento cruzado cranial (LCCr) é uma das causas mais frequentes de claudicação, cuja sequela inevitável é a osteoartrose (OA) (Doom et al., 2008; de Bruin et al., 2005; Tashman et al., 2004).
A instabilidade articular causada pela ruptura do LCCr e o desequilíbrio no metabolismo da cartilagem articular (entre citocinas e fatores de crescimento) exercem um papel fundamental na indução e progressão da OA.
A OA é um processo doloroso e o objetivo primário do tratamento é desacelerar a progressão da doença e aliviar a dor. Dentre os agentes empregados destacam-se os glicosaminoglicanos polissulfatados, o sulfato de condroitina, e o ácido hialurônico intra-articular que podem reduzir a dor, a inflamação e melhorar o ambiente articular, porém sem impedir a progressão da OA. Tem sido relatado também, o uso de anti-inflamatórios não esteroidais (Clark, 2006).
Diante da ausência de efetivo controle da OA, têm sido propostas alternativas de tratamento que se baseiam na aplicação intra-articular de diferentes tipos de células autógenas para favorecer a regeneração dos tecidos lesionados. Essas células possuem características intrínsecas para proliferar e se diferenciar em vários tipos celulares que podem modular a regeneração tecidual. Estas novas terapias são conhecidas como terapia regenerativa (Silva, 2012; Huang et al., 2008; Petrigliano et al., 2006). Dentre elas destaca-se o concentrado autólogo de plaquetas (CAP) que após sua ativação, libera substâncias provenientes dos grânulos presentes no seu citoplasma, principalmente fatores de crescimento e citocinas que tem ação benéfica em lesões ligamentares, lesões traumáticas na cartilagem articular, fraturas e como tratamento coadjuvante da OA adquirida (Patel et al., 2013; Silva, 2012; Milano et al., 2010).
O objetivo do presente estudo é portanto avaliar o efeito precoce do CAP sobre a OA induzida experimentalmente por meio de exames clínicos, radiográficos e ultrassonográficos em coelhos.
Material e Métodos
Animais
O projeto foi aprovado pela Comissão de Ética no Uso de Animais (CEUA) da Universidade Federal de Minas Gerais sob o nº 63 de 2014.
Foram usados 14 coelhos da raça Nova Zelândia, adultos jovens, machos com massa corporal média de 3,0 kg. O critério de inclusão dos animais na pesquisa foi seu estado geral saudável e ausência de alterações no sistema locomotor (ossos, articulações, músculos, tendões) confirmados pela avaliação física, hemograma e bioquímica sanguínea, exame ortopédico e exame radiográfico nas incidências ventrodorsal e mediolateral. Os animais foram mantidos no laboratório de metabolismo animal do departamento de Zootecnia em gaiolas individuais de 60 cm x 60 cm x 37 cm com acesso a água ad libitum e alimentação duas vezes por dia de acordo as necessidades nutricionais específicas.
Os coelhos foram divididos em dois grupos de sete animais de acordo com o tratamento. Os animais do grupo I constituíram o grupo controle e receberam 0,5 ml intra-articular de solução Ringer Lactato e os animais do grupo II constituíram o grupo CAP e receberam 0,5 ml intra-articular de CAP numa concentração de 1,5 a 2,5 vezes os níveis basais.
Aproximadamente 30 minutos antes de iniciar os procedimentos cirúrgicos foi aplicado pela via intravenosa cefalotina sódica (Pharma, Aspen pharma, Rio de Janeiro, Brasil) na dose de 30 mg/kg que continuou até o quinto dia pós-cirúrgico. A analgesia pós-cirúrgica foi feita empregando-se tramadol (Cristal Pharma, Belo Horizonte, Brasil) na dose de 1 mg/kg por via SC a cada 12 horas, durante três dias e terapia anti-inflamatória com meloxicam (Ourofino, Uberaba, Brasil) na dose de 0,2 mg/kg por via IM a cada 24 horas durante três dias. Após a cirurgia os animais foram mantidos nas respetivas gaiolas individuais sob supervisão diária, sem imobilização do membro operado.
Foram usados três tempos de avaliação. No tempo 1 (M1), os animais foram submetidos às avaliações clínica, ortopédica, radiográfica, ultrassonográfica e artroscópica. As radiografias foram feitas nas projeções craniocaudal e mediolateral das articulações femoro-tíbio-patelares (FTP) de ambos os membros posteriores (VMI COMPACTO 500, BRAZIL), seguidas da avaliação ultrassonográfica do MPD (MINDRAY M5, probe linear de 7,5 mHz). Posteriormente foram submetidos a exame artroscópico (KARL STORZ) da articulação FTP direitos e seguiu-se a transecção do LCCr.
No tempo 2 (M2) após três semanas, todos os animais foram submetidos às avaliações clínicas e de imagem já citadas e encaminhados para avaliação artroscópica seguida da estabilização articular empregando-se auto-enxerto de fáscia lata segundo Schawalder e Gitterle (1989) com o objetivo de controlar a progresão da OA, diminuir as lesões nas estruturas que conformam a articulação e simular as condições clínicas ás que são submetidos os animais de estimação rotineiramente. Foram colhidos, antes da artroscopia, dois ml de sangue em tubos com EDTA para hemograma e obtenção de plasma no qual foi determinada a concentração dos fatores de crescimento PDGF e TGF β1. Nos animais do grupo II (CAP) foram colhidos adicionalmente sete ml de sangue para obtenção do concentrado autólogo de plaquetas.
Os animais receberam os tratamentos de acordo com o grupo ao qual foram alocados. Os animais do grupo I receberam 0,5 ml intra-articular de solução de Ringer Lactato e os animais do grupo II receberam 0,5 ml intra-articular de CAP.
No tempo 3, após 15 dias da substituição do LCCr e injeção do CAP ou Ringer Lactato, todos os animais foram novamente submetidos a avaliações clínica, ortopédica, ultrassonográfica e radiográfica e encaminhados para avaliação artroscópica. Antes da artroscopia procedeu-se à coleta de sangue para os exames já mencionados.
Procedimentos
Anestesia
Todos os procedimentos realizados como medicação pré-anestésica (MPA), indução e manutenção da anestesia seguiram protocolos desenvolvidos pela equipe de anestesiologia do Hospital Veterinário da Escola de Veterinária da UFMG.
Ruptura do LCCr (M1)
Foi feita uma punção no recesso supra-patelar com uma agulha hipodérmica 22G para coleta do líquido sinovial, seguido da dilatação da articulação com infusão de 3 ml de Ringer Lactato. Em seguida foram feitas duas incisões na pele de aproximadamente 3 mm, lateral e medial ao ligamento patelar, que foram empregadas como portais de acesso para o artroscópio e os instrumentos. Seguiu-se um ponto de reparo com nylon 3-0 adjacente aos portais medial e lateral e na inserção do ligamento patelar envolvendo parcialmente o coxim adiposo infra-patelar para evitar o deslizamento da pele e a perda dos portais artroscópicos.
Utilizou-se uma lâmina de bisturi número 11 para perfurar a cápsula articular, seguindo-se a introdução da camisa artroscópica de 2,2 mm guiada por trocarte rombo. O sistema de irrigação foi conectado à bainha artroscópica e o trocarte foi substituído pelo artroscópio de 1,9 mm acoplado à câmera. Procedeu-se à inspeção artroscópica sistemática das estruturas intra-articulares iniciando pelo recesso supra patelar, compartimento medial, compartimento lateral, fossa intertrocantérica, ligamento cruzado cranial e caudal e meniscos.
Após a avaliação e sob visibilização artroscópica procedeu-se à ruptura do LCCr utilizando-se uma agulha hipodérmica 18G.
Reparação do LCCr (M2)
A substituição do ligamento foi realizada segundo Schawalder e Gitterle (1989) após avaliação artroscópica da articulação conforme os procedimentos descritos anteriormente. Foi feita uma incisão na pele iniciando no terço proximal do fêmur e estendendo-se até a fabela lateral, seguida da divulsão do tecido subcutâneo e exposição da fáscia lata. Foi feita uma pequena incisão inicial com lâmina de bisturi número 11 que foi completada com tesoura Metzembaum para colheita do enxerto de cerca de 8 cm de extensão por um cm de largura. O enxerto foi liberado no extremo proximal e manteve-se pediculado na altura da fabela lateral. Com uma furadeira pneumática e um pino de 2,5 mm de diâmetro foi feito um túnel tibial iniciando-se no platêu da tíbia e emergindo próximo à tuberosidade tíbial, na face medial. Uma pinça de Deschamps foi usada para tracionar o enxerto através da fossa intercondilar e com um fio de aço de 0,8 mm o enxerto foi tracionado através do túnel tibial e fixado na sua extremidade livre sobre a tuberosidade da tíbia com fio poliglecaprone 2-0 em padrão simples separado. O tecido subcutâneo e a pele foram fechados de forma rotineira.
Após a substituição do LCCr os animais foram distribuídos aleatoriamente em um dos grupos experimentais e receberam injeções intra-articulares de acordo com os tratamentos estabelecidos.
Avaliação clínica e ortopédica
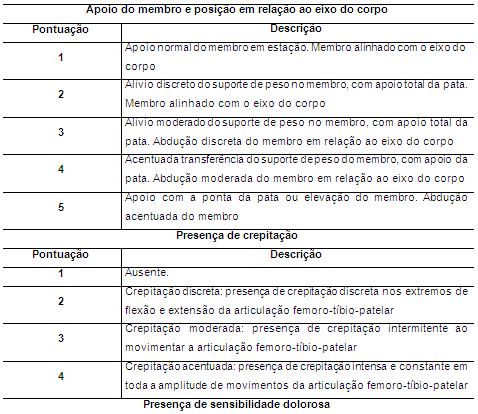
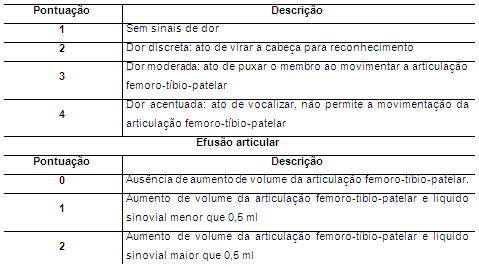
Foram realizadas avaliações clínica e ortopédica em ambos os grupos considerando parâmetros como apoio do membro e abdução, crepitação, sensibilidade dolorosa à palpação e presença ou não de efusão articular com base na tabela proposta por Muzzi et al. (2009) (Tabela 1).
Tabela 1. Sistema de classificação do apoio do membro e abdução, da crepitação, da efusão articular e da sensibilidade dolorosa de coelhos portadores de OA experimental tratados com CAP ou solução de Ringer Lactato intra-articular
Para avaliar o apoio do membro os coelhos foram observados em diferentes situações. Foi feita primeiramente uma observação na gaiola e em seguida os coelhos foram dispostos sobre uma mesa onde foram avaliados subjetivamente o suporte do peso nos membros posteriores em posição anatómica, em movimento e a posição do membro operado em relação ao eixo longitudinal do corpo. Os coelhos foram dispostos num corredor de dez metros quadrados onde se permitiu a livre deambulação dos animais.
Para avaliar a crepitação, os coelhos foram dispostos em decúbito lateral sobre uma mesa e procedeu-se a flexão e extensão de ambos os membros. Uma mão foi disposta sobre a articulação FTP e com a outra sobre a região do metatarso foram realizados os movimentos de flexão e extensão. Considerou-se a presença ou não e o grau de crepitação durante a amplitude de o movimento articular.
Ainda em decúbito lateral foi avaliada a sensibilidade dolorosa durante os movimentos de flexão e extensão da articulação e pressionando suavemente a patela, o ligamento patelar e os espaços articulares parapatelar medial e lateral. Como efusão foi considerada o aumento de volume flutuante da articulação FTP e o afastamento da patela do sulco troclear observado na radiografia.
Avaliação radiográfica
Foram realizadas avaliações radiográficas (VMI COMPACTO 500, BRAZIL) em ambos os grupos e em ambas as articulações FTP nos posicionamentos craniocaudal e mediolateral antes da ruptura (M1), após a estabilização articular (M2) e aos 15 dias (M3). Nesta análise foram considerados parâmetros como presença de osteófitos (ausente: 0; discretos: 1; moderados: 2 e acentuados: 3), efusão articular (ausente: 0 e presente: 1), esclerose do osso subcondral tibial (ausente: 0 e presente: 1). Estes dados foram usados para obter o grau da intensidade da OA (discreta: 1; moderada: 2 e acentuada: 3). Cada parâmetro foi avaliado segundo o descrito por Innes et al. (2004).
As radiografias foram avaliadas por três avaliadores diferentes e a classificação do grau da osteoartrose foi feita segundo os sinais radiográficos presentes.
Avaliação ultrassonográfica
Imediatamente antes dos procedimentos artroscópicos e radiográficos no momento M1 e após os mesmos procedimentos no M2 e M3 os coelhos foram encaminhados para avaliação ultrassonográfica da articulação (MINDRAY M5, probe linear de 7,5 mHz).
Os animais foram dispostos em decúbito lateral esquerdo visando observar a superfície articular da tíbia, do fêmur, da patela, do ligamento patelar e o espaço da articulação FTP do MPD. Considerou-se a regularidade da superfície óssea para se fizer uma correlação com os achados radiográficos.
Foi avaliada a espessura do ligamento patelar, a superfície do osso subcondral e a área correspondente à cartilagem e ao líquido sinovial. Esses dados foram comparados através do teste ‘t’ para comparar as diferenças entre os grupos e entre os tempos experimentais. Os achados foram classificados em ausência de alterações (score 0), alterações discretas (score 1), alterações moderadas (score 2) e alterações acentuadas (score 3).
Resultados e Discussão
Avaliação ortopédica
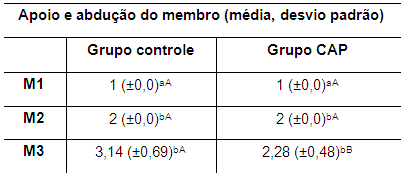
Os resultados da avaliação ortopédica dentro e entre os grupos nos diferentes momentos são apresentados nas tabelas 2, 3, 4, e 5. Houve dificuldade para avaliar a deambulação dos coelhos devido ao temperamento desta espécie e à locomoção rápida e saltitante. Foram comparadas as médias do apoio e da abdução do membro nos diferentes grupos e momentos avaliados (Tabela 2).
Tabela 2. Valores da média e desvio padrão do apoio e abdução do membro posterior direito de coelhos dos grupos I e II nos momentos M1, M2 e M3 M1: momento 1; M2: momento 2; M3: momento 3. CAP: concentrado autólogo de plaquetas. a-b: letras minúsculas diferentes nas colunas apresentam diferença estatisticamente significativa (p<0,05) no teste t. A-B: letras maiúsculas diferentes nas linhas apresentam diferença estatisticamente significativa (p<0,05) no teste t.
Nos grupos controle e CAP observou-se diferença estatisticamente significativa (p<0,05) quando comparados M1 com M2 e M3, mas não houve diferença significativa entre M2 e M3 nos grupos controle e CAP.
Entre grupos, entretanto, verificou-se diferença estatisticamente significativa no M3, com melhor apoio e menor abdução do membro no grupo que recebeu o CAP intra-articular (Tabela 2). Observou-se, em ambos os grupos, no M2, discreto alívio do suporte do peso com discreta abdução do MPD, o que é esperado devido à instabilidade articular. Quinze dias após a estabilização articular verificou-se em cinco coelhos (75,4 %) do grupo CAP quadro similar ao observado no M2 e abdução do membro com alívio moderado do suporte do peso em dois animais (28,5 %).
Embora tenha ocorrido melhora da deambulação 15 dias após a estabilização e injeção de CAP (M3), esta não retornou aos níveis iniciais, devido ao processo degenerativo já instalado. Além disto, neste período, apenas uma aplicação de CAP tinha sido realizada, tempo ainda curto para se obtiver efeito ainda mais expressivo do CAP. O efeito dos procedimentos artroscópicos e da reparação do LCCr apresenta-se como uma variável que pode afetar os resultados da avaliação clínica como conseqüência das alterações feitas nos tecidos. Embora essa variável possa influir nos resultados clínicos, as cirurgias são feitas com o objetivo de causar o processo degenerativo e acompanhar sua evolução depois de empregado o tratamento.
No grupo controle, entretanto, observou-se neste mesmo intervalo de tempo (M3), alívio discreto do suporte de peso em um animal (14,28 %), alívio moderado do suporte do peso em quatro animais (57,14 %) e transferência do suporte do peso em dois (28,57 %), mesmo após a estabilização articular. Observou-se neste grupo maior desconforto clínico. Isto leva a concluir que o após a primeira injeção do CAP se observa ação benéfica sobre a articulação com redução da dor e consequente melhora do apoio do membro.
Quando comparados os grupos CAP e controle, observou-se diferença significativa no apoio e abdução do membro no M3. O melhor uso do membro no grupo CAP provavelmente seja devido ao controle da inflamação neste grupo. O CAP modula a inflamação e favorece a reparação tecidual diminuindo assim o processo inflamatório e a dor pela ação dos fatores de crescimento e suas funções no metabolismo celular. Sugere-se que o efeito clínico positivo sobre o apoio e abdução do membro tratado seja associado ao CAP e seus efeitos anti-inflamatórioe e moduladores durante o processo de cicatrização, conforme o reportado na literatura (García-Denche, 2006; Froum et al., 2002; Gale e Yancopoulos, 1999).
A evolução do processo degenerativo é influenciada pela degradação da matriz extracelular (MEC) e pelas alterações nos tecidos articulares (Canapp, 2013; Konttinen et al., 2012). A perda dos elementos constituintes da cartilagem, a formação de osteófitos, a exposição do osso subcondral e a inflamação da cápsula sinovial causam dor e limitam o uso do membro (Brandt, 1989). O quadro clínico menos acentuado no grupo CAP se deve possivelmente à ação dos fatores de crescimento que atuam na redução da liberação de enzimas degradativas e da inflamação e propicia maior conforto aos animais.
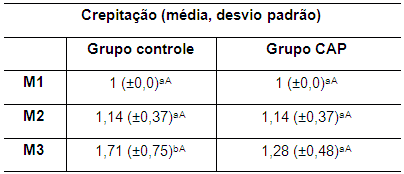
Em relação à crepitação nos grupos controle e CAP não houve diferença estatisticamente significativa entre os tempos M1 e M2, mas foi observada diferença significativa (p<0,05) entre M1 e M3 e entre M2 e M3 no grupo controle, indicando aumento da crepitação ao longo do tempo de estudo neste grupo. Por outro lado, nos coelhos do grupo CAP, não se observou diferença significativa entre M2 e M3, sugerindo a ação benéfica do CAP (Tabela 3).
Tabela 3. Valores da média e desvio padrão do grau de crepitação articular em coelhos de ambos os grupos no M1, M2 e M3 M1: momento 1; M2: momento 2; M3: momento 3. CAP: concentrado autólogo de plaquetas. a-b: letras minúsculas diferentes nas colunas apresentam diferença estatisticamente significativa (p<0,05) no teste t. A-B: letras maiúsculas diferentes nas linhas apresentam diferença estatisticamente significativa (p<0,05) no teste t. ente significativa (p<0,05) no teste t.
Entre os grupos, entretanto, não se verificou diferença significativa nos tempos avaliados, apesar de a crepitação no grupo CAP apresentar um valor numérico inferior ao do grupo controle no M3.
De fato, a crepitação era semelhante em ambos os grupos no M2, pois até então ambos os grupos receberam o mesmo tratamento. A diferença se manifestou clinicamente no M3 (Tabela 3). As radiografias não mostravam evidências da presença de osteófitos. A crepitação pode ocorrer pela presença de osteófitos ou pelo atrito entre estruturas (Rayward et al., 2004). A visibilização radiográfica é mais tardia.
Os animais do grupo CAP apresentaram evolução mais lenta dos sinais clínicos característicos do processo degenerativo, devido possivelmente ao efeito do CAP que auxilia na proliferação, diferenciação e mitose celular (Werner e Grose, 2003; Heldin e Westermark, 1999) migração de células epiteliais e angiogênese (García-Denche, 2006; Gao et al., 1999), que controlam o processo inflamatório e pode ter ação no controle da progressão do processo articular degenerativo.
A OA afeta as articulações sinoviais, causando destruição de a cartilagem articular e alterações que provocam inflamação, dor, claudicação e formação de osteófitos (Zhu et al., 2013; Franklin et al., 2009; Liu et al., 2003), como evidenciado nesta pesquisa ainda em curto tempo de observação.
A OA é caracterizada pela degeneração da cartilagem articular, que se torna mais fina e desgastada, pela eburnação do osso subcondral e formação de osteófitos marginais (Beckwee et al., 2013; Mercuri, 2008). Segundo Muzzi et al. (2009) a presença de crepitação está relacionada com o aumento progressivo de osteófitos peri-articulares enquanto Johnson e Johnson (1993) afirmam que esse fato está diretamente relacionado com a progressão do processo degenerativo, como evidenciado em dois coelhos do grupo controle. Muito embora o período de observação tenha sido curto, pode-se verificar maior conforto dos animais no grupo CAP.
Os fatores de crescimento modulam o processo inflamatório e favorecem o aporte de substâncias anti-inflamatórias que podem minimizar as alterações na cartilagem, na MEC e consequentemente, desacelerar o avanço da OA e a manifestação dos sinais clínicos (Saito et al., 2009), conforme observado nos resultados deste estudo.
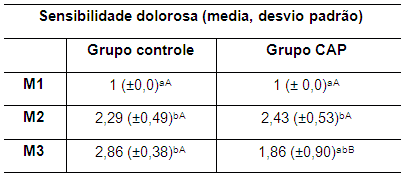
A dor variou de discreta a moderada e as médias da sensibilidade dolorosa em ambos os grupos cujos valores são apresentados na tabela 4. Observou-se em ambos os grupos sensibilidade dolorosa no M2, o que já era esperado, visto que ambos foram submetidos ao mesmo tratamento.
Tabela 4. Valores da média e desvio padrão da sensibilidade dolorosa da articulação FTP de coelhos de ambos os grupos no M1, M2 e M3 M1: momento 1; M2: momento 2; M3: momento 3. CAP: concentrado autólogo de plaquetas. a-b: letras minúsculas diferentes nas colunas apresentam diferença estatisticamente significativa (p<0,05) no teste t. A-B: letras maiúsculas diferentes nas linhas apresentam diferença estatisticamente significativa (p<0,05) no teste t.
Diferença estatisticamente significativa foi verificada entre M1 e M2 em ambos os grupos e entre M1 e M3 apenas no grupo controle (Tabela 4). Houve, portanto, redução da sensibilidade dolorosa no grupo CAP, atribuida ao efeito do concentrado autólogo de plaquetas que contém fatores de crescimento e citocinas que regulam e modulam o processo inflamatório (Rezende et al., 2016). Os valores das médias de ambos os grupos evidenciaram diferença significativa (p<0,05) entre ambos os grupos no M3 (Tabela 4).
A degradação progressiva de a cartilagem articular leva à inflamação sinovial, formação de osteófitos, esclerose do osso subcondral e exposição do osso que provocam dor (Vidotto et al., 2013; Ayral et al., 2005; Lavigne et al., 2005). A dor presente na OA pode decorrer da pressão sobre as terminações nervosas nas regiões onde se desenvolvem os osteófitos, de microfraturas no osso subcondral ou da distensão da cápsula articular (Brandt, 1989). Todos esses fatores associados limitam o uso da articulação com consequente claudicação e apoio limitado do membro, fato observado neste experimento, principalmente nos coelhos do grupo controle.
A redução da dor nos coelhos do grupo CAP no momento M3, isto é, duas semanas após a injeção do CAP está de acordo com o relatado por Saito et al. (2009) sobre o efeito favorável da injeção intra-articular de CAP. Segundo o referido autor, o CAP intra-articular retarda a evolução do processo degenerativo, a formação de osteófitos e a perda da cartilagem. Apesar de ter sido feita apenas uma única aplicação de CAP, pode-se observar sua ação favorável no controle da dor em relação ao grupo controle. Estes resultados têm efeito também na amplitude do movimento articular como mostra a tabela 5.
Tabela 5. Valores da média e desvio padrão dos ângulos de flexão e extensão da articulação FTP de coelhos de ambos os grupos no M1, M2 e M3 MPD: membro posterior direito; MPE: membro posterior esquerdo; M1: momento 1; M2: momento 2; M3: momento 3; CAP: concentrado autólogo de plaquetas; F: flexão; E: extensão. a-b: letras minúsculas diferentes nas colunas apresentam diferença estatisticamente significativa (p<0,05) no teste t. A-B: letras maiúsculas diferentes nas linhas apresentam diferença estatisticamente significativa (p<0,05) no teste t.
Verificou-se no grupo controle diferença estatística significativa (p<0,05) nas médias da flexão do MPD no M1 em relação ao M2 e ao M3, porém sem diferença significativa entre M2 e M3. Apesar de a estabilização articular, houve um impacto negativo na amplitude de movimento articular (Tabela 5) traduzido pelo aumento significativo na média do ângulo de flexão e redução significativa da média do ângulo de extensão.
Nos coelhos do grupo CAP, houve aos 15 dias após a estabilização e injeção intra-articular de CAP (M3) redução não significativa do ângulo de flexão em relação ao M2, mas manteve-se distante dos valores iniciais, apesar da melhora clínica de alguns parâmetros clínicos.
Entre os grupos observou-se diferença significativa (p<0,05) das médias entre M2 e M3 (Tabela 5).
Nos membros contralaterais, em ambos os grupos, não foram observadas alterações nos diferentes momentos em relação à amplitude do movimento articular, contrário ao relatado por Innes et al. (2000) que, em avaliações tardias, e em situação diferente deste estudo, observaram na articulação FTP de cães com ruptura do LCCr alterações significativas no membro contralateral com aumento de volume articular e alterações na amplitude de movimento. O tempo de avaliação dos coelhos neste estudo ainda é precoce e a biomecânica da articulação do coelho é diferente da articulação do cão.
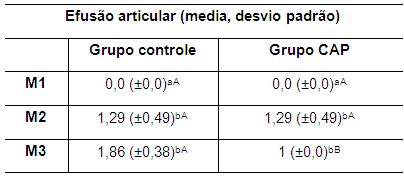
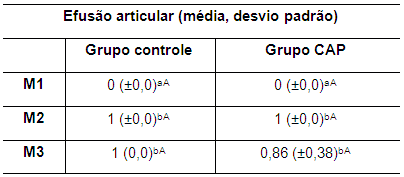
A efusão articular foi observada em ambos os grupos nos momentos M2 e M3, traduzida pelo discreto aumento de volume flutuante da articulação e pela comprovação após a coleta do líquido sinovial. Esse aumento foi de cerca de 0,4 a 0,8 ml, considerando que quando possível, a colheita do líquido sinovial no M1 correspondeu a 0,1 ml. Os valores das médias da efusão articular para ambos os grupos nos três momentos avaliados são apresentadas na tabela 6.
Tabela 6. Valores da média e desvio padrão do parâmetro efusão articular de coelhos de ambos os grupos nos momentos M1, M2 e M3
M1: momento 1; M2: momento 2; M3: momento 3. CAP: concentrado autólogo de plaquetas. a-b: letras minúsculas diferentes nas colunas apresentam diferença estatisticamente significativa (p<0,05) no teste t. A-B: letras maiúsculas diferentes nas linhas apresentam diferença estatisticamente significativa (p<0,05) no teste t.
Diferença estatisticamente significativa (p<0,05) nos valores das médias entre M1 e M2 foi observada em ambos os grupos e entre M1 e M3 no grupo controle somente (Tabela 6). Entre os grupos, verificou-se diferença significativa (p<0,05) nos valores das médias da efusão articular no M3 (Tabela 6).
Vale salientar que esta avaliação é subjetiva e está diretamente relacionada com a sensibilidade do examinador e pode ser influenciada pelo espessamento da cápsula articular. Entretanto, nos momentos M2 e M3 foi coletada maior quantidade de líquido sinovial compatível com articulação submetida a injúrias. Verificou-se diferença significativa entre os grupos no momento M3 com maior grau de efusão articular no grupo controle. A ruptura do LCCr leva a alterações na qualidade do líquido sinovial e ao aumento na produção do mesmo com consequente efusão articular que pode ser palpada no recesso suprapatelar e no espaço parapatelar (McWilliams e Friedrichs, 2003).
Em resposta a uma injúria os condrócitos e os sinoviócitos liberam citocinas que causam vasodilatação dos capilares subsinoviais com aumento na permeabilidade vascular e saída de fluido, proteínas e células inflamatórias para o espaço articular (MacWilliams e Friedrichs, 2003). Nos coelhos do grupo controle observou-se aumento dos scores da efusão articular confirmados pelo maior volume de líquido sinovial coletado no momento M3.
Entretanto, apenas dois animais (28,57 %) do grupo tratado mostraram redução da efusão articular, mas também não houve aumento nos demais. É possível que após aplicações subseqüentes do CAP como no protocolo usado por Silva (2012) se obtenha maior efeito, podendo ocorrer o retorno aos parâmetros considerados normais ou próximos do normal.
Segundo Carter et al. (1999) e Gardner (1994) a liberação de substâncias e enzimas que degradam a MEC como as metaloproteinases, a IL-1 e o FNTα leva à degradação da cartilagem articular e induzem a inflamação local e mudanças bioquímicas que conduzem a alterações como sinovite (Bolon et al., 2004; Guilak et al., 1994). O CAP modula o processo inflamatório, diminuindo a inflamação e a degradação da cartilagem articular (Iacopetti et al., 2012; Henrotin et al., 2012).
Avaliação radiográfica
Os achados radiográficos dos coelhos de ambos os grupos no M2 e no M3 são apresentados na figura 1. A comparação entre as médias dos parâmetros avaliados encontra-se nas tabelas 7, 8, 9 e 10.
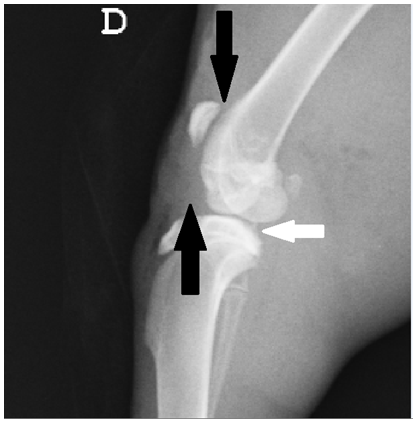
Figura 1. Radiografia mediolateral de coelhos do grupo controle no momento M2. Presença de osteófitos na superfície do plateu da tíbia (seta branca cheia). Efusão articular evidenciada pelo afastamento da patela do sulco da tróclea e pelo aumento da radiopacidade com perda da sombra do coxim adiposo infrapatelar (setas pretas).
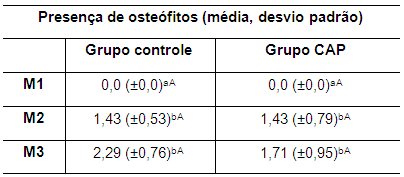
No M1 todos os animais mostravam as articulações saudáveis, sem alterações visíveis. A tabela 7 apresenta os valores da média e desvio padrão referente à presença de osteófitos periarticulares de ambos os grupos no M1, M2 e M3. A tabela 8 apresenta os valores da média da efusão articular observado na radiografia nos grupos avaliados e em todos os momentos. A tabela 9 apresenta os valores da média e do desvio da variável esclerose subcondral e a tabela 10 mostra os valores da média e desvio padrão da intensidade do processo degenerativo em ambos os grupos. O exame radiográfico permitiu acompanhar as alterações ósseas e a evolução da OA no período previsto.
No M2, verificou-se em ambos os grupos presença de osteófitos na extremidade distal da patela em 85,71 % dos animais (6/7) e efusão articular em todos os animais de ambos os grupos (Figura 1).
A presença de osteófitos no pós-cirúrgico foi similar entre os grupos com diferença estatística significativa (p<0,05) entre as médias no M1 em relação ao M2 e M3. Os achados radiográficos indicam alterações compatíveis com o processo articular degenerativo com aparente menor progressão no grupo que recebeu o CAP intra-articular (Figura 1). Os valores das médias da presença de osteófitos nos tempos avaliados são apresentados na tabela 7.
Tabela 7. Valores da média e do desvio padrão do parâmetro presença de osteófitos nos coelhos de ambos os grupos no M1, M2 e M3
M1: momento 1; M2: momento 2; M3: momento 3. CAP: concentrado autólogo de plaquetas. a-b: letras minúsculas diferentes nas colunas apresentam diferença estatisticamente significativa (p<0,05) no teste t. A-B: letras maiúsculas diferentes nas linhas apresentam diferença estatisticamente significativa (p<0,05) no teste t.
A osteofitose é um achado comum após ruptura do LCCr. No estudo de Innes et al. (2004) e Rayward et al. (2004) foi encontrado um aumento significativo no score da osteofitose ao longo do tempo de observação. Em geral, os osteófitos são observados no plateu tibial, nos ossos sesamoides lateral e medial, na borda distal da patela e na região pericondilar (Louboutin et al., 2009), também constatado neste experimento, em ambos os grupos.
A presença de osteófitos pode resultar em limitação de a função articular devido ao aumento da sensibilidade dolorosa que interfere na amplitude de movimento articular (Mercuri, 2008; Brandt, 1989) e é um dos parâmetros considerado no monitoramento do avanço da OA. Eles podem ser vistos radiograficamente duas semanas após a ruptura do LCCr (Rayward et al., 2004). Neste estudo os osteófitos foram evidenciados radiograficamente três semanas após a ruptura do LCCr, em ambos os grupo.
Na avaliação radiográfica não se observaram alterações compatíveis com a efusão articular no M1, pois os animais estavam saudáveis. Foi observada diferença significativa entre M1 e M2 e entre M1 e M3. Os valores de a efusão articular em ambos os grupos nos momentos avaliados são apresentados na tabela 8.
Tabela 8. Valores da média e do desvio padrão do parâmetro efusão articular em coelhos de ambos os grupos no M1, M2 e M3 M1: momento 1; M2: momento 2; M3: momento 3. CAP: concentrado autólogo de plaquetas. a-b: letras minúsculas diferentes nas colunas apresentam diferença estatisticamente significativa (p<0,05) no teste t. A-B: letras maiúsculas diferentes nas linhas apresentam diferença estatisticamente significativa (p<0,05) no teste t.
Não foram encontradas diferenças estatisticamente significativas entre os grupos nos momentos avaliados, embora tenha sido observada uma discreta redução nos valores da efusão no grupo CAP em relação ao grupo controle no M3 (Tabela 8).
A radiografia da articulação FTP pode evidenciar alguns sinais que indicam a presença e/ou gravidade da OA em acordo com Canapp (2013). A efusão como verificada neste estudo foi observada radiograficamente pelo afastamento da patela em relação à tróclea e pela perda da sombra do coxim adiposo na articulação (Innes et al., 2004; Rayward et al., 2004).
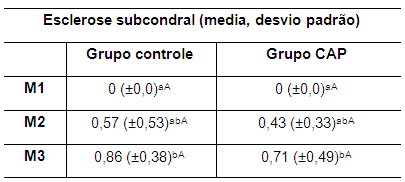
O aumento na quantidade de líquido sinovial leva à efusão articular, em consequência do processo inflamatório após a ruptura do LCCr (Innes et al., 2004). O líquido sinovial em excesso pode conter microcristais que agravam o processo inflamatório e estimulam a dor (Brandt, 1989), que reflete no uso do membro, como observado no grupo controle e em menor gravidade no grupo CAP. Outro parâmetro considerado na evolução da OA é a esclerose subcondral, cujos resultados foram semelhantes em ambos os grupos, sem diferença estatisticamente significativa entre M1 e M2 e entre M2 e M3, embora tenha sido evidenciado discreto aumento nos valores. Contudo, em ambos os grupos houve diferença significativa (p<0,05) entre M1 e M3, indicando surgimento da esclerose óssea. Os valores das médias da esclerose subcondral nos coelhos de ambos os grupos, nos três momentos, são mostrados na tabela 9.
Tabela 9. Valores da média e do desvio padrão do parâmetro esclerose subcondral nos coelhos de ambos os grupos no M1, M2 e M3 M1: momento 1; M2: momento 2; M3: momento 3. CAP: concentrado autólogo de plaquetas. a-b: letras minúsculas diferentes nas colunas apresentam diferença estatisticamente significativa (p<0,05) no teste t. A-B: letras maiúsculas diferentes nas linhas apresentam diferença estatisticamente significativa (p<0,05) no teste t.
Os valores da média entre os grupos não evidenciaram diferença estatisticamente significativa em nenhum dos momentos avaliados. Os resultados semelhantes entre os grupos sugerem que o CAP não controla a progressão da esclerose subcondral, pelo menos após aplicação única.
A esclerose subcondral reflete alteração na estrutura do osso, com diminuição da porosidade, que é observada na radiografia como uma área mais radiopaca com perda do padrão trabecular (Ribeiro, 2011).
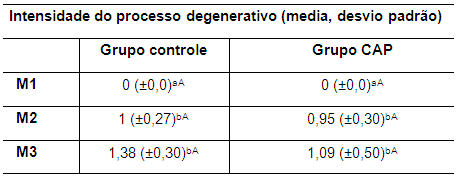
A presença dos achados radiográficos mencionados levou a graduar a intensidade da OA. Os valores da média da intensidade do processo degenerativo são apresentados na tabela 10. A associação dos parâmetros presença de osteófitos, efusão articular e esclerose subcondral possibilitou a estimativa da intensidade do processo articular degenerativo.
Tabela 10. Valores da média e do desvio padrão do parâmetro intensidade do processo degenerativo em coelhos de ambos os grupos no M1, M2 e M3
M1: momento 1; M2: momento 2; M3: momento 3. CAP: concentrado autólogo de plaquetas. a-b: letras minúsculas diferentes nas colunas apresentam diferença estatisticamente significativa (p<0,05) no teste t. A-B: letras maiúsculas diferentes nas linhas apresentam diferença estatisticamente significativa (p<0,05) no teste t.
Nos estágios iniciais do processo degenerativo as alterações radiográficas são mínimas e estas avançam conforme a cronicidade da lesão (Innes et al., 2004). Neste experimento osteófitos foram observados em ambos os grupos e o uso do CAP não preveniu seu aparecimento.
Do ponto de vista clínico os coelhos do grupo controle mostraram menor uso do membro, maior efusão articular e valores baixos na avaliação ortopédica geral quando comparados com os coelhos do grupo CAP. Isto leva a concluir que o CAP tem efeito favorável sobre os tecidos articulares minimizando os efeitos clínicos de o processo articular degenerativo, porém esses efeitos benéficos não são evidenciados radiograficamente.
Os valores da média da intensidade do processo degenerativo do grupo CAP, mostraram um padrão similar ao do grupo controle, com diferença estatisticamente significativa (p<0,05) entre M1 e M2 e entre M1 e M3, evidenciando a progressão da OA, assim como no grupo controle.
Possivelmente alguma diferença poderia ser observada no final do protocolo de três aplicações de CAP. Embora tenha sido observado um efeito clínico positivo nos animais que receberam o CAP, não foi possível observar esse mesmo efeito do ponto de vista radiográfico.
No membro contralateral não foram encontradas alterações radiográficas em nenhum dos grupos nos tempos estudados.
A evolução do processo degenerativo, como citado por Innes et al. (2004) foi observada também neste estudo com os coelhos, porém verificou-se melhor score clínico nos animais tratados com CAP. O tempo de avaliação ainda é curto, mas pode-se supor um aparente controle do processo inflamatório que por sua vez poderia retardar a evolução do processo degenerativo. Um acompanhamento radiográfico em longo prazo se faz necessário.
Avaliação ultrassonográfica
O ultrassom permite a avaliação articular, inclusive de erosão da cartilagem (Guermazi et al., 2013), mas o tamanho reduzido da articulação FTP dos coelhos impede uma avaliação mais detalhada das estruturas intra-articulares bem como a visibilização dos ligamentos cruzados cranial e caudal (Oliveira et al., 2009). A impossibilidade do ultrassom para diferenciar o líquido sinovial da cartilagem articular não permite uma avaliação mais acurada, fazendo desta, uma técnica menos sensível para a avaliação da OA em coelhos. Essa dificuldade pode ter influenciado os valores da média e os resultados obtidos. Os resultados da avaliação ultrassonográfica são apresentados nas tabelas 11 e 12, como média e desvio padrão.
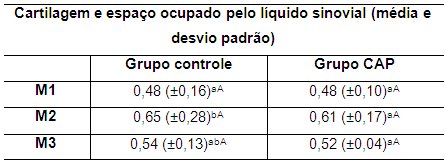
Tabela 11. Valores da média e do desvio padrão da espessura da cartilagem e espaço ocupado pelo líquido sinovial em coelhos de ambos os grupos no M1, M2 e M3 M1: momento 1; M2: momento 2; M3: momento 3. CAP: concentrado autólogo de plaquetas. a-b: letras minúsculas diferentes nas colunas apresentam diferença estatisticamente significativa (p<0,05) no teste t. A-B: letras maiúsculas diferentes nas linhas apresentam diferença estatisticamente significativa (p<0,05) no teste t.
No grupo controle foi observada diferença estatisticamente significativa (p<0,05) entre as médias de M1 e M2 (Tabela 11), porém sem diferença significativa entre M1 e M3 e entre M2 e M3.
No grupo CAP não foram observadas diferenças estatisticamente significativas nos momentos avaliados. Observou-se padrão similar de comportamento em relação às médias dos coelhos do grupo controle, registrando discreta diminuição na espessura da cartilagem no M3.
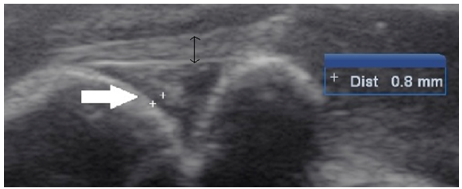
O aumento no valor da média no M2 está relacionado com a instauração do processo degenerativo e consequente aumento na produção do líquido sinovial (Figura 2). Já no M3 a discreta redução no valor da média no grupo CAP em relação ao M2, se deve possivelmente a diminuição na produção do líquido sinovial. Embora tenha sido registrada uma diminuição da média no M3, esta não alcançou os valores iniciais do M1.
Figura 2. Imagem ultrassonográfica da articulação FTP de coelho.Faixa anecogênica (seta branca e cursores) representando o espaço ocupado pela cartilagem articular somado ao líquido sinovial. Ligamento patelar (seta preta fina).
Aos 15 dias após a estabilização articular (M3), verificou-se em ambos os grupos diminuição do valor da média da espessura da cartilagem e do espaço ocupado pelo líquido sinovial em relação ao M2. No grupo CAP esta redução foi maior, porém, os valores se mantiveram altos em relação ao valor inicial. Esta redução maior no grupo CAP se deve provavelmente ao efeito anti-inflamatório do CAP que reduz as enzimas degradativas da cartilagem articular (Schwartz et al., 2011; Sanz et al., 2006), sugerindo o efeito benéfico do CAP. No grupo controle o efeito se deve à estabilização articular. Os valores da espessura do ligamento patelar em ambos os grupos nos diferentes momentos avaliados são apresentados na tabela 12.
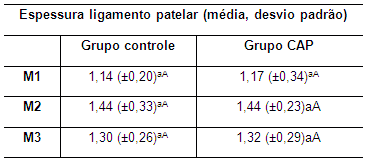
Tabela 12. Valores da média e do desvio padrão da espessura do ligamento patelar em coelhos de ambos os grupos no M1, M2 e M3 M1: momento 1; M2: momento 2; M3: momento 3. CAP: concentrado autólogo de plaquetas. a-b: letras minúsculas diferentes nas colunas apresentam diferença estatisticamente significativa (p<0,05) no teste t. A-B: letras maiúsculas diferentes nas linhas apresentam diferença estatisticamente significativa (p<0,05) no teste t.
Em ambos os grupos se observou diferença estatisticamente significativa nos valores das médias da espessura do ligamento patelar em nenhum dos tempos avaliados, embora tenha sido observado um aumento discreto da média no M2 em relação ao M1 (Tabela 12). No entanto, no M3, evidenciou-se discreta redução da média dessa variável quando comparado com o M2, mas sem alcançar os valores observados no M1 (Tabela 12).
No processo degenerativo há proliferação das vilosidades, presença de fibrina e cordões fibrosos na tentativa de estabilizar a articulação. O aumento na espessura do ligamento patelar no M2 é causado, pelo processo inflamatório que leva à espessura dos tecidos intra e extra-articular (Oliveira et al., 2009; Gnudi e Bertoni, 2001). Isto explica o aumento no valor da média nesse momento.
Durante o curso de a OA a cápsula articular torna-se mais espessa e com aumento da vascularização. Os sinoviócitos são uma fonte importante de citocinas e leucotrienos, os quais contribuem adicionalmente para as mudanças articulares atraindo células inflamatórias e liberando prostaglandinas e outros mediadores inflamatórios. As articulações com OA mostram hipertrofia das vilosidades da sinóvia e aumento na quantidade de colágeno maduro e imaturo nos tecidos intra-articulares (Johnston, 1997; Baines, 1994), fato que pode contribuir para o aumento da espessura do ligamento patelar em ambos os grupos no M2.
O exame ultrassonográfico é usado rotineiramente no homem e em eqüinos para avaliar diferentes alterações articulares e tendinosas (Flynn e Whitcomb, 2002). Em animais de companhia, a ultrassonografia articular é um método de diagnóstico ainda pouco utilizado. É um exame não invasivo, não utiliza radiação ionizante e permite a observação de estruturas intra-articulares (Muzzi et al., 2001; Schnappauf et al., 2001). O ultrassom é utilizado na avaliação de tecidos moles do membro torácico e pélvico como musculatura, tendões e ligamentos (Flynn e Whitcomb, 2002), bem como das superfícies articulares.
Apesar de ainda pouco utilizada para avaliação articular em pequenos animais, a ultrassonografia permitiu avaliar a articulação FTP, suas principais estruturas e as mudanças progressivas que ocorreram durante o período de estudo, embora não tenham sido evidenciadas alterações significativas do processo degenerativodevido provavelmente, ao curto tempo de observação. O pequeno tamanho da articulação, também pode ter influenciado.
Muzzi et al. (2009) observaram alterações discretas nas superfícies ósseas 30 dias após a cirurgia de reparação do LCCr que progrediram para alterações moderadas ou acentuadas com a evolução do processo degenerativo. As alterações da superfície óssea são mais comumente observadas nas fases crônicas, o que justifica a ausência de achados semelhantes neste estudo. Muzzi et al. (2001) salienta também a eficácia do exame ultrassonográfico na identificação precoce de osteófitos intra-articulares em relação ao exame radiográfico, diferente dos resultados nesta pesquisa. Possivelmente o tamanho da articulação seja um fator limitante.
Embora o tempo de avaliação nesta pesquisa tenha sido curto, foi possível através de o exame ultrassonográfico identificar as principais estruturas que compõem a articulação FTP e observar alterações na cartilagem articular e no ligamento patelar decorrentes do processo degenerativo. Avaliações mais tardias são sugeridas.
Conclusões
Os resultados obtidos nesta pesquisa permitem concluir que o CAP propicia um efeito clínico benéfico sobre a articulação com OA, não impede o avanço das alterações degenerativas, mas ameniza os sintomas clínicos. Os métodos de imagem são ferramentas que auxiliam na avaliação da intensidade e da progressão da osteoartrose.
Referências bibliográficas
· Ayral, X. et al. Synovitis: A potential predictive factor of structural progression of medial tibiofemoral knee osteoarthritis. Results of a 1 year longitudinal arthroscopic study in 422 patients. Osteoarthr Cartilage, v. 13, p. 361-367, 2005. · Baines, S. Histopathological changes in synovial membrane in cranial cruciate ligament rupture. In: BSAVA Congress, n. 1, 1994, Birmingham. · Beckwee, D. et al. Osteoarthritis of the knee: Why does exercise work? A qualitative study of the literature. Ageing Res Rev, v. 12, n. 1, p. 226-236, 2013. · Bolon, B. et al. Interleukin-1beta and tumor necrosis factor alpha produce distinct, time-dependent patterns of acute arthritis in the rat knee. Vet Pathol, v. 41, n. 3, p. 235-243, 2004. · Brandt, K.D. Pain, synovitis, and articular cartilage changes in osteoarthritis. Semin Arthritis Rheum, v. 18, n. 4, supl. 2, p. 77-80, 1989. · Carter, S.D.; BARNES, A.; GILMORE, W.H. Canine rheumatoid arthritis and inflammatory cytokines. Vet Immunol Immunopathol, v. 69, p. 201-214, 1999. · Clark, T.P. The clinical pharmacology of ciclooxigenase-2-selective and dual inhibitors. VetClin North Am Small Anim Pract, v. 36, n. 5, p. 1061-1085, 2006. · de Bruin, T. et al. Interleukin-8 mRNA expression in synovial fluid of canine stifle joints with osteoarthritis. Vet Immunol and Immunopathol, v. 108, n. 3-4, p. 387-397, 2005. · Doom, M. et al. Immunopathological mechanisms in dogs with rupture of the cranial cruciate ligament. Vet Immunol Immunopathol, v. 125, n. 1-2, p. 143-161, 2008. · Flynn, K.A.; Whitcomb, M.B. Equine meniscal injuries: A retrospective study of 14 horses. Proc Am Assoc Equine Pract, v. 48, p. 249-254, 2002. · Franklin, S.P.; Park, R.D.; Egger, E.L. Metacarpophalangeal and metatarsophalangeal osteoarthritis in 49 dogs. J Am Anim Hosp Assoc, v. 45, n. 3, p. 112-117, 2009. · Froum, S.J. et al. Effect of platelet-rich plasma on bone growth and osseointegration in human maxillary sinus grafts: Three bilateral case reports. Int J Periodontics Restorative Dent, v. 22, n. 1, p. 45-54, 2002. · Gale, N.W.; Yancopoulos, G.D. Growth factors acting via endothelial cell-specific receptor tyrosine kinases: VEGFs, angiopoietins, and ephrins in vascular development. Genes Dev, v. 13, n. 9, p. 1055-1066, 1999. · Gao, J.; Symons, A.L.; Bartold, M.P. Expression of transforming growth factor β receptors types II and III within various cells in the rat periodontium. J Periodont Res, v. 34, n. 2, p. 113-122, 1999. · Gardner, D.L. Problems and paradigms in joint pathology. J Anat, v. 184, Pt. 3, 1994. · Gnudi, G.; Bertoni, G. Echografic examination of the stifle joint affected by cranial cruciate ligament rupture in the dog. Vet Radiol Ultrasound, v. 42, n. 3, p. 266-270, 2001. · Guermazi, A. et al. Osteoarthritis: A review of strengths and weaknesses of different imaging options. Rheum Dis Clin N Am, v. 39, n. 3, p. 567-591, 2013. · Guilak, F. et al. Mechanical and biochemical changes in the superficial zone of articular cartilage in canine experimental osteoarthritis. J Orthop Res, v. 12, n. 4, p. 474-484, 1994. · Heldin, C.H.; Westermark, B. Mechanism of action and in vivo role of platelet-derived growth factor. Physiol Rev, v. 79, n. 4, p. 1283-1316, 1999. · Henrotin, Y. et al. Usefulness of specific OA biomarkers, Coll2-1 and Coll2-1NO2, in the anterior cruciate ligament OA canine model. Osteoarthritis Cartilage, v. 20, n. 7, p. 787-790, 2012. · Huang, T.F. et al. Isolation and characterization of mesenchymal stromal cells from human anterior cruciate ligament. Cytotherapy, v. 10, n. 8, p. 806-814, 2008. · Iacopetti, I. et al. Application of Platelet-Rich Gel to Enhance Wound Healing in the Horse: A Case Report. J Equine Vet Sci, v. 32, n. 3, p. 123-128, 2012. · Innes, J.F. et al. Long-term outcome of surgery for dogs with cranial cruciate ligament deficiency. Vet Rec, v. 147, n. 12, p. 325-328, 2000. · Innes, J.F.; Costello, M.; Barr, M.J. Radiographic progression of osteoarthritis of the canine stifle joint: A prospective study. Vet Rad Ultrasound, v. 45, n. 2, p. 143-148, 2004. · Johnson, J.M.; Johnson, A.L. Cranial cruciate ligament rupture: Pathogenesis, diagnosis and postoperative rehabilitation. Vet Clin N Am: Small Anim Pract, v. 23, n. 4, p. 717-733, 1993. · Johnston, S. Osteoarthritis. Vet Clin N Am: Small Anim Pract, v. 27, n. 4, 1997. · Konttinen, Y.T. et al. Osteoarthritis as an autoinflammatory disease caused by chondrocyte-mediated inflammatory responses. Arthritis Rheum, v. 64, n. 3, p. 613-616, 2012. · Lavigne, P. et al. Subchondral and trabecular bone metabolism regulation in canine experimental knee osteoarthritis. OsteoArthritis Cartilage, v. 13, n. 4, p. 310-317, 2005. · Louboutin, H. et al. Osteoarthritis in patients with anterior cruciate ligament rupture: A review of risk factors. Knee, v. 16, n. 4, p. 239-244, 2009. · Liu, W.; Burton-Wurster, N.; Glant, T.T. Spontaneous and experimental osteoarthritis in dog: Similarities and differences in proteoglycan levels. J Orthop Res, v. 21, n. 4, p. 730-737, 2003. · MaCwilliams, P.S.; Friedrichs, K.R. Laboratory evaluation and interpretation of synovial fluid. Vet Clin North Am Small Anim, v. 33, n. 1, p. 153-178, 2003. · Mercuri, L.G. Osteoarthritis, osteoarthrosis, and idiopathic condylar resorption. Oral Maxillofacial Surg Clin N Am, v. 20, n. 2, p. 169-183, 2008. · Milano, G. et al. The effect of platelet rich plasma combined with microfractures on the treatment of chondral defects: An experimental study in a sheep model. Osteoarthritis Cartilage, v. 18, n. 7, p. 971-980, 2010. · Muzzi, L.A.L. et al. Ultra-sonografia da articulação femoro-tibio-patelar em caes normais. Cienc Animal, v. 11, p. 209, 2001. · Muzzi, L.A.L.; Rezende, C.M.F.; Muzzi, R.A.L. Fisioterapia apos substituição artroscopica do ligamento cruzado cranial em caes. I - avaliacao clinica, radiografica e ultrassonografica. Arq Bras Med Vet Zootec, v. 61, n. 4, p. 805-814, 2009. · Oliveira, R.R. et al. Radiografia e ultrassonografia no diagnostico da ruptura do ligamento cruzado cranial em caes. Pesq Vet Bras, v. 29, n. 8, p. 661-665, 2009. · Patel, S. et al. Treatment with Platelet-Rich plasma is more effective than Placebo for knee Osteoarthritis: A Prospective, Double-Blind, Randomized Trial. Am J Sports Med, v. 41, n. 2, p. 356-364, 2013. · Pelisson, C.F.; TRAPP, S.M.; KEMPER, B. Estudo comparativo in vitro do movimento de gaveta em joelhos de caninos submetidos a duas tecnicas extracapsulares de correcao da instabilidade apos ruptura do ligamento cruzado cranial. Cienc Rural, v. 40, n. 6, p. 1335-1340, 2010. · Petrigliano, F.P.; McAllister, D.R.; Wu, B.M. Tissue engineering for anterior cruciate ligament reconstruction: A review of current strategies. J Arthr Rel Surg, v. 22, n. 4, p. 441-451, 2006. · Rayward, R.M.; Thomson, D.G.; Davies, J.V. Progression of osteoarthritis following TPLO surgery: A prospective radiographic study of 40 dogs. J Small Anim Pract, v. 45, p. 92-97, 2004. · Rezende, C.M.F. et al. Intra-articular autologous platelet concentrate (APC) in the treatment of induced knee osteoarthritis (OA) in rabbits – An arthroscopic evaluation. Intech. Disponível em: Link. · Ribeiro, A.S.C. O uso de artroscopia no diagnóstico e tratamento da displasia do cotovelo canino. Lisboa, Portugal: Universidade Tecnica de Lisboa, 2011. Dissertacao (Mestrado integrado em Medicina Veterinaria). · Rychel, J.K. Diagnosis and treatment of osteoarthritis. Top Companion Anim Med, v. 25, n. 1, p. 20-25, 2010. · Saito, M. et al. Intraarticular administration of platelet-rich plasma with biodegradable gelatin hydrogel microspheres prevents osteoarthritis progression in the rabbit knee. Clin Exp Rheumatol, v. 27, n. 2, p. 201-207, 2009. · Sanz, S.C.; Bruges-Armas, J.; Beaumont-Herrero, G. Importancia do osso subcondral e da membrana sinovial na patogenia e no tratamento da osteoartrose. Acta Reum Port, v. 31, p. 205-213, 2006. · Schawalder, P.; Gitterle, E. Eigene methoden zur operativen rekonstruktion bei rupturen des vorderen und hinteren kreuzbandes. Kleintierpraxis, v. 7, p. 323-330, 1989. · Schnappauf, A. et al. Ultrasound of the canine stifle and its importance in cranial cruciate ligament rupture in dogs. Vet Radiol Ultrasound, v. 42, n. 4, p. 359-394, 2001. · Schwartz, A.; Martinez-Sanchez, G.; Re, L. Growth factors derived from platelet and its applications in regenerative medicine. Potential use of ozone as activator. Rev Esp Ozonoter, v. 1, n. 1, p. 54-73, 2011. · Silva, R.F. Caracterizações celular e ultra-estrutural do concentrado de plaquetas em cães e gatos e avaliação do seu efeito na osteoartrose em cães. Belo Horizonte, Minas Gerais: Universidade Federal de Minas Gerais, 2012. Tese (Doutorado em Ciencia Animal). · Tashman, S. et al. Kinematics of the ACL-deficient canine knee during gait: Serial changes over two years. J Orthop Res, v. 22, n. 5, p. 931-941, 2004. · Tatarunas, A.C.; Matera, J.M.; Franchini, M.L. Analise de liquido sinovial em caes: Revisao de literatura. Rev Educ Contin CRMV-SP, v. 7, n. 1, p. 7-14, 2004. · Vidotto, V.T. et al. Estudo comparativo do uso de meloxicam por via intra-articular e sistemica no controle da osteoartrite experimentalmente induzida em joelho de coelhos. Rev Bras Ortop, v. 48, n. 6, p. 524-531, 2013. · Werner, S.; Grose, R. Regulation of wound healing by growth factors and cytokines. Physiol Rev, v. 83, n. 3, p. 835-870, 2003. · Zhu, Y. et al. Basic science and clinical application of platelet-rich plasma for cartilage defects and osteoarthritis: A review. Osteoarthritis Cartilage, v. 21, n. 1, p. 1627-1637, 2013.
Como citar: Osorio-Carmona, E. et al. Avaliação clínica, radiográfica e ultrassonográfica precoce da osteoartrose induzida em coelhos e tratados com concentrado autólogo de plaquetas. Revista Veterinaria y Zootecnia, v. 12, n. 1, p. 35-61, 2018. Recuperado de: http://vetzootec.ucaldas.edu.co/index.php/component/content/article?id=244. DOI: 10.17151/vetzo.2018.12.1.4
Esta obra está bajo una Licencia de Creative Commons Reconocimiento CC BY
|