|
Análisis citogenético en hembras Bos taurus: idiograma, carioidiograma y bandas Ag-NOR
Alejandro Clavijo-Maldonado1, 2
1 Tecnoacademia Maizales. Centro de Automatización Industrial, SENA Regional Caldas. Manizales, Colombia. 2 Centro para la Formación Cafetera, SENA Regional Caldas. Manizales, Colombia.
This email address is being protected from spambots. You need JavaScript enabled to view it.
Recibido: 26 de agosto de 2017 y Aprobado: 13 de febrero de 2018, Actualizado: 05 de junio de 2018
DOI: 10.17151/vetzo.2018.12.2.2
RESUMEN: El objetivo del presente estudio es analizar el cariotipo bovino mediante la elaboración del cariograma, idiograma y carioidiograma; además, de identificar las regiones organizadoras de nucléolo (NOR) en bovinos de la especie Bos taurus. Muestras de sangre de hembras bovinas fueron cultivadas en períodos de 66 y 72 horas. El análisis citogenético, incluyó tinción convencional con Giemsa y bandeo Ag-NOR. El número diploide fue 2n = 60 y el número fundamental NF = 58. Para la clasificación cromosómica se halló tanto el índice centromérico (r) como la longitud cromosómica total relativa (% LT). El cariotipo se clasificó en tres grupos: grupo A, con 12 pares de cromosomas telocéntricos de tamaño mediano; grupo B, con 17 cromosomas telocéntricos pequeños y grupo C, con cromosomas sexuales metacéntricos. La tendencia en tamaño y forma fue analizada por medio del idiograma y carioidiograma. Seis NOR fueron identificadas en cuatro cromosomas del grupo A y dos del grupo B.
Palabras clave: bandeo cromosómico, bovino, cariotipo, cromosoma, cultivo celular.
Cytogenetic Analysis in Bos taurus females: ideogram, karyo-ideogram, Ag-NOR banding
ABSTRACT: The objective of the present study is to analyze the bovine karyotype through the elaboration of the karyogram, ideogram and karyoideogram, in addition to identifying the Nuclear Organizer Regions (NORs) in cattle of the species Bos taurus. Female cattle blood samples were cultured in periods of 66 and 72 hours. The cytogenetic analysis included conventional Giemsa staining and banding Ag-NOR. The diploid number was 2n = 60 and the fundamental number FN = 58. For the chromosomal classification, both the centromeric index (r) and total chromosomal relative length (TL %) were found. The karyotype was classified into three groups, group A with 12 pairs of medium size telocentric chromosomes, group B with 17 small telocentric chromosomes, and group C with metacentric sex chromosomes. The trend in size and shape was analyzed by means of the ideogram and the karyoideogram. Six NORs were identified in four chromosomes from group A and two from Group B.
Key words: chromosome banding, bovine, karyotype, chromosome, cell culture.
Introducción
Los avances en la ciencia de la citogenética han permitido la descripción de los cromosomas con suficiente detalle a fin de facilitar su identificación inequívoca, especialmente al cromosoma X (Gustavsson, 1991) y la caracterización de los complementos cromosómicos (Ford et al., 1980). La nomenclatura estandarizada para animales domésticos mediante bandeo cromosómico (Ford et al., 1980; DiBerardino et al., 1990) está basada en el sistema de clasificación humano de la Conferencia de Paris, de 1971, cuyo objeto fue el describir los cromosomas y las regiones cromosómicas reveladas por las diversas técnicas que para aquel tiempo eran novedosas (Hamerton et al., 1972).
La citogenética animal asocia el complemento cromosómico y sus características con las funciones anatómicas o fisiológicas generales, considerándolas en conjunto (Fechheimer, 1979). Por tanto, permite detectar y evaluar anormalidades cromosómicas numéricas y estructurales (Iannuzzi, 2010) y la posibilidad de mejorar las características animales (Carlyle & Duncan, 1990; Barragán, 2005).
En los bovinos la citogenética ha contribuido a la clasificación y nomenclatura mediante técnicas de bandeo (Wurster & Bernirshke, 1968; Ford et al., 1980), identificación de regiones organizadoras de nucléolo (bandas NOR) (Mayr & Gruber, 1987; Iannuzzi, 2010), bandas-Q y la aplicación de bromodesoxiuridina (BrdU) para estudios de conservación cromosómica de la familia (Gallagher & Womak, 1992), bandas-C en estudios comparativos del cromosoma Y (Halnan & Watson, 1982), identificación de aberraciones estructurales (Parma et al., 2010; Biltueva et al., 2014; Trukhachev et al., 2017) y numéricas (Kochneva & Zhidenova, 2010; Kochneva et al., 2011).
En reproducción ganadera la identificación, localización y frecuencia de aparición de cromosomas de células con bandas NOR en búfalos permite establecer su relación con la variación entre razas de animales para reproducción (Iannuzzi et al., 1996). Las aberraciones cromosómicas son un criterio de selección de toros reproductores (Ahmad et al., 2004). Los cromosomas sexuales son los más estudiados. El análisis sobre el cromosoma Y mediante bandeo-C, bandeo-R e hibridización in situ permite identificar rápidamente la presencia y extensión de posibles alteraciones reproductivas en toros (Di Meo et al., 2005; Yimer & Rosnina, 2014). Por ejemplo, la detección de procesos de introgresión genética en razas criollas por cruces Bos taurus x Bos indicus en Colombia y Brasil es evidenciada por el dimorfismo en el cromosoma Y de tipo acrocéntrico, submetacéntrico y metacéntrico (Sánchez et al., 2008; Issa et al., 2009; Canavez et al., 2012); semejante a lo hallado en ganado blanco y negro polaco (Parada et al., 2017). Sin embargo no todos los polimorfismos, en este cromosoma, implican alteraciones en la fertilidad (Stranzinger et al., 2007). El objetivo del presente estudio es hacer un análisis del cariotipo bovino mediante la elaboración del cariograma, idiograma y carioidiograma; además, de identificar las NOR en bovinos de la especie Bos taurus.
Materiales y Métodos
Toma de muestras de sangre
En la Granja Los Cerezos, del SENA Regional Caldas, se efectuó la toma de muestras de sangre de 5 hembras bovinas Bos taurus mediante punción venosa aséptica. Se almacenaron 10 ml de sangre en tubos vacutainer heparinizados (BD Franklin Lakes). Las muestras fueron transportadas y almacenadas en refrigeración (4-6ºC) hasta su procesamiento en un período menor a cuatro horas tras la toma.
Cultivo celular
Se siguió el protocolo sugerido por Moorhead et al. (1960) y Verma & Babú (1989). Cada muestra se sembró por duplicado, depositando 2 ml de sangre en frascos de cultivo de 75 cm2; a los cuales se les adicionó 6 ml de cultivo RPMI 1640 y 2 ml de suero fetal bovino con el fin de que se hallara una concentración de 20%, 300 µl de fitohemaglutinina y 100 µl de solución antibiótica de penicilina-estreptomicina. Los tiempos de incubación fueron de 66 horas y 72 para las muestras por duplicado a una temperatura de 38,5ºC.
Cosecha celular
A una hora de finalizar el tiempo de cultivo (65 y 71 horas, respectivamente) se adicionó colchicina a concentración de 0,016% 200 µl. Finalizado el período de cultivo, la muestra fue centrifugada a 1000 rpm durante 15 minutos y el sobrenadante fue descartado. Se adicionó la solución hipotónica (KCl 0,075 M), precalentada, dejando en incubación nuevamente por 30 minutos a 38,5ºC. Posteriormente se realizó la prefijación y la fijación de las células con solución de Carnoy 3:1 (3 partes metanol: 1 parte ácido acético glacial) recién preparada y en frío. Los lavados del material celular se efectuaron con la misma solución, centrifugando a 1000 rpm por 10 minutos hasta que el pellet estuviera de color blanquecino. La deposición en lámina se realizó de manera convencional, dejando secar el extendido al aire libre y se efectuó la tinción con Giemsa, lavando los excesos con agua destilada y dejando secar nuevamente al aire.
Bandeo-NOR
Se envejecieron las láminas con material celular en cámara de desecación durante siete días. Se adoptó el protocolo sugerido por Howell & Black (1980) en el que, a cada una, en sentido horizontal, se adicionó cinco gotas de gelatina ácida al 2% y siete de nitrato de plata (AgNO3) al 50% para homogenizar. Las láminas se cubrieron con cubreobjetos, evitando la formación de burbujas e incubando en baño maría a 60ºC hasta obtener un color marrón. El cubreobjetos se desprendió mediante lavado con agua destilada y se dejó secar al aire libre.
Cariotipo, idiograma y carioidiograma
El conteo cromosómico se realizó sobre células en estado de metafase con buena dispersión y diferenciación cromosómica bajo microscopio de fluorescencia Nikon Eclipse Ci; para la toma de las microfotografías se empleó el software Nikon NIS-Elements y el procesamiento de imágenes fue realizado en los programas Adobe Photoshop CC y Adobe Illustrator CC. En total se analizaron 65 metafases.
Las medidas de brazo largo (BL) y brazo corto (BC) se realizaron mediante el programa ImageJ (NIH Image) en escala de micras. Luego, las medidas fueron promediadas. La determinación de la longitud total de cada cromosoma fue obtenida mediante la suma de los brazos (LT = BL+BC). La longitud total relativa (% LT) se estimó mediante el índice de Reig et al. (1980). A la clasificación cromosómica, mediante el índice centromérico (r), se le aplicó el índice de Levan et al. (1964); en donde r = % BL / % BC. Todos estos parámetros fueron usados para la identificación de cada par cromosómico, los cuales fueron ordenados de acuerdo a la Primera Conferencia Internacional para la Estandarización de Bandeo de Cariotipos de Animales Domésticos (Ford et al., 1980).
Resultados y Discusión
El mejor tiempo de incubación para células linfocitarias bovinas es de 72 horas. De allí se obtuvieron células en metafase con un adecuado tamaño para su análisis, entre tanto los cultivos de 66 horas presentaron una deficiente morfología cromosómica. Esto concuerda con los procedimientos efectuados por Ahmad et al. (2004), Di Meo et al. (2005), Jantarat et al. (2009), Marafiga et al. (2014), con variaciones en tiempo de acción de colchicina (Issa et al., 2009).
El complemento cromosómico es 2n (diploide) = 60, NF (numero fundamental) = 58. La familia Bovidae posee una alta conservación dado que el cariotipo característico oscila entre 2n = 48 – 60, NF = 58; a excepción del búfalo cuyo NF = 56 (Jantarat et al., 2009; Marafiga et al., 2014). Todos los cromosomas somáticos hallados son telocéntricos, distribuidos en dos grupos: el primero (grupo A) 12 pares de tamaño mediano y el segundo (grupo B) compuesto por 17 pares; por último, un tercer grupo (grupo C) en el que se encuentran los cromosomas sexuales (Tm12 + Tp17 + M1 = 58 + XX o 60, XX); lo cual aplica a hembras Bos taurus con cariotipo normal (Figura 1).
Figura 1. Cromosomas teñidos mediante tinción convencional con Giemsa. Escala = 10 µm. Cromosomas dispersos en metafase (arriba) y cariotipo (abajo).
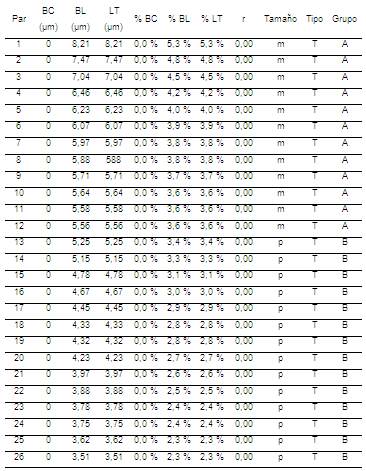
El cromosoma X es metacéntrico, siendo este par el más grande de todo el complemento (Tabla 1).
Tabla 1. Medidas cromosómicas de metafases y clasificación por forma y tamaño del complemento de hembras Bos taurus
BC= brazo corto; BL= brazo largo; LT= longitud total; r= índice centromérico; T= telocéntrico; m= mediano; p= pequeño; g= grande.
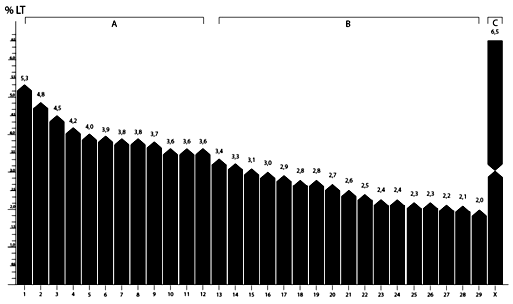
Los pares con mayor longitud relativa total del complemento cromosómico en hembras Bos taurus son: el par sexual con 6,5%; seguido del par 1 del complemento de cromosomas autosómicos y del grupo A con 5,3%; finalizando este grupo con el par 12 con 3,6%; mientras que el grupo B inicia con el par 13 y una longitud relativa de 3,4%, cerrando con el par 29 con 2% LT con una tendencia decreciente (Jantarat et al., 2009; Canavez et al., 2012) (Tabla 1) (Figura 2).
Figura 2. Idiograma de hembras Bos taurus 2n = 60. LT= longitud total.
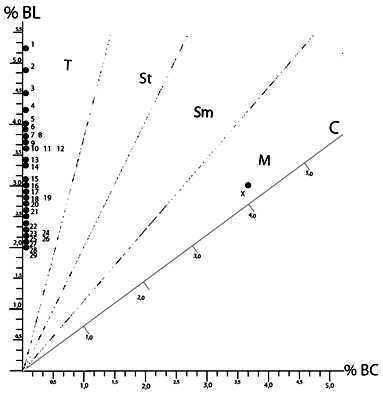
No hubo dificultad para la identificación y determinación de los pares cromosómicos. El carioidiograma evidencia la tendencia de todo el complemento cromosómico a partir de las longitudes relativas de los brazos largos y cortos (Spotorno, 1985; Spotorno et al., 1995) (Figura 3).
Figura 3. Carioidiograma de longitudes relativas de conteos cromosómicos de metafases de hembras Bos taurus. BC= brazo corto; BL= brazo largo; C= centrómero; M = metacéntrico; Sm = submetacéntrico; St = subtelocéntrico; T= telocéntrico.
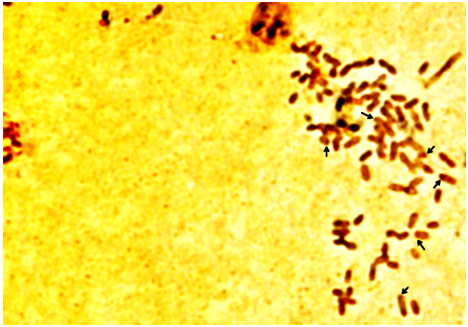
Las NOR son sitios específicos en los cromosomas de alta transcripción de genes ribosomales, por lo cual la cromatina es dispersa en estas regiones (Iannuzi et al., 1996). A través de la tinción con AgNO3 se observan 6 cromosomas positivos a bandas-NOR, cromosomas telocéntricos medianos pertenecientes al grupo A y dos del grupo B; esto concuerda con lo hallado por Iannuzi et al. (1996), Jantarat (2009) y Marafiga et al. (2014) (Figura 4).
Figura 4. Tinción Ag-NOR en cromosomas de hembra Bos taurus. Las flechas indican las regiones positivas a tinción argéntica referentes a las NOR.
Conclusiones
La presente investigación constituye la primera experiencia realizada en estudios citogenéticos con miras a realizar caracterizaciones cromosómicas aplicadas a los procesos productivos y a las limitaciones de la ganadería de la región. Adicionalmente se reafirma el alto índice de conservación que presenta la familia Bovidae; lo cual es completamente favorable al permitir, a partir del análisis citogenético, realizar procesos de selección animal con miras al mejoramiento genético. Sin embargo se debe tener en cuenta que la citogenética clásica presenta claras limitaciones, particularmente en la detección de pequeños cambios en la estructura cromosómica que no son perceptibles en un estudio citogenético convencional. Por su parte el conocimiento del complemento cromosómico y la disposición del mismo, sumado con bandas cromosómicas que tienen importancia como marcadores, son preponderantes en los primeros acercamientos de estudio de individuos objeto de un programa de mejoramiento animal para luego apoyarse en herramientas más finas como las moleculares. Asimismo, se presenta la aplicación del carioidiograma como una técnica que representa la tendencia del complemento cromosómico; técnica, que ha sido utilizada en especies silvestres. Sin embargo es importante aplicar tal proceso en caracterización de especies domésticas, especialmente si se trata de programas de selección animal.
Agradecimientos
Los autores agradecen a TecnoParque Nodo Manizales del Centro de Procesos Industriales SENA Regional Caldas, en especial a la “Línea de Biotecnología” por facilitar el acceso a elementos de cultivo celular. El proyecto fue financiado por el Sistema de Investigación, Desarrollo Tecnológico e Innovación ―SENNOVA― del SENA.
Referencias bibliográficas
Como citar: Clavijo-Maldonado, A. et al. Análisis citogenético en hembras Bos taurus: idiograma, carioidiograma y bandas Ag-NOR. Revista Veterinaria y Zootecnia, v. 12, n. 2, p. 10-21, 2018. http://vetzootec.ucaldas.edu.co/index.php/component/content/article?id=252. DOI: 10.17151/vetzo.2018.12.2.2 |