|
Determinación de Leptospira spp. en humanos y bovinos pertenecientes al municipio de Toca, Boyacá
ARTÍCULO DE INVESTIGACIÓN
Martín Pulido-Medellín
1 MSc. Docente Asociado de Parasitología. Grupo de Investigación GIDIMEVETZ, Programa de Medicina Veterinaria y Zootecnia, Universidad Pedagógica y Tecnológica de Colombia. Tunja, Colombia. 2 MSc (c). Grupo de Investigación GIDIMEVETZ, Programa de Medicina Veterinaria y Zootecnia, Universidad Pedagógica y Tecnológica de Colombia. Tunja, Colombia. 3 MSc. Docente Asociado UNINCCA. Líder Grupo de Investigación en Parasitología y Microbiología Tropical –GIPAMT–. Programa de Biología, Facultad de Ingenierías, Administración y Ciencias Básicas, Universidad INCCA de Colombia. Bogotá, Colombia.
This email address is being protected from spambots. You need JavaScript enabled to view it.
Recibido: 21 de Enero de 2017 y aprobado: 9 de Junio de 2017, Actualizado: 7 de Septiembre de 2017
DOI: 10.17151/vetzo.2017.11.2.5
RESUMEN: Objetivo: Determinar la prevalencia de Leptospira spp. en humanos y bovinos del municipio de Toca (Boyacá) mediante la técnica de Microaglutinación-lisis (MAT) e identificar los serovares de Leptospira presentes en los hatos lecheros. Materiales y Métodos: Se realizó un estudio de corte transversal, con el fin de determinar anticuerpos contra diversos serovares de Leptospira spp. Se tomaron muestras de sangre en tubos sin anticoagulante de 37 trabajadores y 133 hembras bovinas del municipio de Toca (Boyacá). El análisis de laboratorio se hizo a través de la técnica de MAT. Los serovares investigados fueron icterohaemorrhagiae, pomona, hardjo, canicola, sejroë y autumnalis. Resultados: Se encontró una prevalencia en bovinos del 54,2% (64/133), además positividad para los serovares L. icterohaemorrhagiae 11,3%, L. pomona 13,5%, L. hardjo 6,0%, L. canicola 8,3%, L. sejroë 6,8% y L. autumnalis 8,3%. Para humanos la prevalencia encontrada fue de 29,7% (11/37) con positividad para L. icterohaemorrhagiae 5,4%, L. pomona 5,4%, L. hardjo 2,7%, L. autumnalis 5,4% y L. canicola 10,8%. El serovar sejroë fue negativo en humanos. Conclusiones: La presencia de leptospirosis en bovinos de leche puede representar una amenaza para la producción pecuaria. Además, al encontrar individuos positivos a Leptospira, se muestra una implicación de salud pública en la zona analizada debido al carácter zoonótico del patógeno.
Palabras clave: leptospirosis, salud pública, bovinos, prevalencia, suero. (DeCS).
Determination of Leptospira spp. in humans and cattle from to the municipality of Toca, Boyacá - Colombia
ABSTRACT: Objective: To determine the prevalence of Leptospira spp. in humans and cattle in the municipality of Toca (Boyacá) using the microagglutination-lysis technique (MAT) and to identify the Leptospira serovars present in dairy herds. Materials and Methods: A cross-sectional study was made to determine antibodies against several Leptospira spp. serovars. Blood samples from 37 workers and 133 female bovines from the municipality of Toca (Boyacá) were taken in tubes without anticoagulant. The laboratory analysis was done through the MAT technique. The serovars investigated were icterohaemorrhagiae, pomona, hardjo, canicola, sejroë and autumnalis. Results: A prevalence of 54.2% (64/133) was found in cattle, as well as positivity to L. icterohaemorrhagiae 11.3%, L. pomona 13.5%, L. hardjo 6.0%, L. canicola 8.3%, L. sejroë 6.8%, and L. autumnalis 8.3%. For humans, the prevalence found was 29.7% (11/37) with positivity for the serovars L. icterohaemorrhagiae 5.4%, L. pomona 5.4%, L. hardjo 2.7%, L. autumnalis 5.4%, L. canicola 10,8%. The sejroë serovar was negative in humans. Conclusions: The presence of leptospirosis in dairy cattle can mean a threat to livestock production. In addition, finding positive individuals to Leptospira shows a public health implication in the analyzed area due to the zoonotic nature of the pathogen.
Key words: leptospirosis, public health, cattle, prevalence, serum. (DeCS).
Introducción
En la actualidad, la leptospirosis es una enfermedad considerada reemergente debido al aumento en su incidencia a nivel mundial, además, es de tipo zoonótico constituyendo un problema de salud pública tanto en países industrializados como en vía de desarrollo (Dupouey et al., 2014). Se ha estimado más de un millón de casos por año en el mundo, y la infección se centra en regiones tropicales y subtropicales, con una marcada incidencia en el Sureste de Asia, Centro y Sur América (Smolinski et al., 2003; Benacer et al., 2016). La leptospirosis es ocasionada por espiroquetas patógenas del género Leptospira, este ha sido reorganizado recientemente y ahora se clasifica en 17 especies y cuatro genomoespecies de Leptospira, con más de 200 serotipos diferentes de Leptospira reconocidos que se clasifican en 23 serogrupos, sin embargo, la mitad de todos los serovares patógenos son clasificados en Leptospira interrogans o Leptospira borgpetersenii (Adler et al., 2011).
La leptospirosis es una enfermedad sistémica que afecta a humanos y animales domésticos, predominantemente caninos, bovinos y suinos, incluyendo animales silvestres, todos estos eliminan el microorganismo por la orina llegando a presentar una enfermedad leve y autolimitada, hasta una enfermedad mortal que incluye insuficiencia multiorgánica; el roedor es el hospedero más importante ya que se encuentra asociado ecológicamente con el humano en mayor medida (Adler & De la Peña Moctezuma, 2010). Esta infección puede ser transmitida al humano por medio del contacto directo o indirecto de mucosas o piel erosionada con orina de animales infectados o superficies de agua contaminadas, incluyendo lodo o agua en lagos, ríos y arroyos; de igual forma, la ingestión de agua o inhalación de aerosoles puede resultar en infección (Sarkar et al., 2012).
Existen condiciones que favorecen la transmisión como el clima, la presencia y contacto con otros animales reservorios, las prácticas de agricultura, las condiciones sanitarias del ambiente y las prácticas de higiene. En el ganado bovino es una patología que afecta a todas las producciones tanto de carne, leche y doble propósito (Alarcón et al., 2014). La supervivencia de las Leptospiras en el medio depende, en gran medida, de la variación de las condiciones del suelo y del agua contaminada; es muy susceptible a la desecación y a los cambios de pH que se alejan de la neutralidad o de la alcalinidad moderada (Romero-Borges et al., 2016).
La humedad es el factor más importante que rige la persistencia del microorganismo en camas o suelo; el microorganismo sobrevive en agua superficial por mucho tiempo, y es más prolongado el período de supervivencia si se trata de agua estancada donde pueden permanecer tres semanas, 180 días en agua dulce y hasta cerca de un año en soluciones viscosas, como lodos con bajo contenido de materia orgánica; no sobreviven en agua salada, aunque se sabe que en agua corriente sobreviven hasta por 15 días (García-González et al., 2013).
En humanos la leptospirosis clínica se manifiesta con fiebre abrupta, dolor de cabeza, enrojecimiento conjuntival, fotofobia, ictericia, náuseas y vómito (Lin et al., 2008; Shimizu et al., 2014). Los signos clínicos pueden ser totalmente variables y están asociados con el serovar adaptado al hospedero, por ejemplo el serovar hardjo es el más frecuente en bovinos en Norte América, el cual resulta en la presentación de la enfermedad, sin embargo, otros serovares pueden estar asociados con la infeccion por leptospirosis incluyendo icterohaemorrhagiae, bratislava, pomona, canicola y grippotyphosa.
Los bovinos son comúnmente infectados con Leptospiras patógenas, al igual que los roedores, estos excretan la bacteria en la orina durante algún tiempo después de la infección y pueden llegar a transmitir el patógeno de animal a animal o de animal a humano (García et al., 2015). En hembras bovinas los signos de leptospirosis incluyen falla reproductiva, aborto, mortinatos, momificación fetal, terneros débiles, agalactia transitoria e infertilidad. La manifestación crónica de la enfermedad ha sido vista en caballos como uveítis recurrente (Rohrbach et al., 2005), pero no es única de esta especie y puede presentarse ocasionalmente en humanos.
El objetivo de esta investigación fue determinar la prevalencia de Leptospira spp. en humanos y bovinos del municipio de Toca (Boyacá) mediante la ténica de microaglutinación (MAT) e identificar los serovares de Leptospira presentes en trabajadores y bovinos de hatos lecheros.
Materiales y Métodos
Área de estudio
La investigación se realizó en el municipio de Toca (Boyacá), uno de los principales municipios productores de leche del departamento. Las coordenadas geográficas son latitud 5º33’ N y longitud 74°11’ O. Posee una población de 8.749 habitantes, con una densidad de 53 hab/km². Limita al norte con Tuta, al sur con Siachoque, por el oriente con Pesca y al occidente con Tuta y Chivatá. Su extensión total es de 165 km². La altitud de la cabecera municipal es de 2810 msnm, con una temperatura media de 13ºC (Alcaldía de Toca, 2013).
Población de estudio
Mediante un muestreo por conveniencia se incluyeron en el estudio trabajadores de fincas lecheras y hembras bovinas pertenecientes a estas. Se seleccionaron 6 hatos representativos de lechería bovina ubicados en el municipio de Toca (Boyacá).
Bovinos. Se tomaron 133 muestras de hembras en producción de la raza Holstein y Normando, seleccionadas aleatoriamente, con un promedio de edad superior a los 33 meses. Se recolectaron 10 ml de sangre de la vena coccígea caudal, usando tubos tapa roja.
Humanos. Se tomaron 37 muestras de operarios, 11 mujeres y 26 hombres que estaban presentes al momento del muestreo, cuya edad se encontraba entre los 22 y 50 años. La totalidad de la muestra correspondió a operarios de fincas que habían tenido contacto frecuente con los bovinos muestreados. Según información proporcionada al momento de la toma de muestras, ninguno de ellos utilizaba protección personal para la rutina de ordeño, tampoco se reportó la presencia de sintomatología clínica compatible con la enfermedad ni haberla presentado con anterioridad al estudio. Tras la firma del consentimiento informado, se procedió a extraer a cada uno de ellos 10 ml de sangre por venopunción aséptica.
Procesamiento de muestras
Posterior a la toma de sangre, esta se transportó en cavas de refrigeración hasta la llegada al Laboratorio de Parasitología de la Universidad Pedagógica y Tecnológica de Colombia para su centrifugación. El suero resultante se congeló a -20°C hasta su análisis. Se empleó la técnica de Microaglutinación-lisis (MAT) como prueba de referencia recomendada por la OMS para leptospirosis (WHO, 1997). Se evaluó la presencia de anticuerpos contra L. interrogans, en el suero de los individuos y bovinos. Los títulos de sueros reactivos estuvieron en un rango entre 1:50 y 1:1600, a partir de diluciones seriadas que se iniciaron en concentraciones de 1:20.
Los serovares investigados fueron icterohaemorrhagiae, pomona, hardjo, canicola, sejroë y autumnalis según estudios realizados previamente en la zona (Bermúdez et al., 2010). Se consideró positiva la dilución al observar en el microscopio de campo oscuro y con objetivo de 10 x una aglutinación del 50% o más de Leptospiras; tomando como referencia el control positivo, todas las pruebas se consideraron positivas con títulos ≥1:20 según lo registra la literatura (Pedraza et al., 2012; Betancur-Hurtado et al., 2013).
Análisis estadístico
El estudio realizado fue observacional y descriptivo, de corte transversal, con el fin de determinar la prevalencia de la leptospirosis enmarcada en un sistema de producción específico de lechería y su posible presentación en los operarios de estas fincas. Se realizó un análisis descriptivo y se aplicó prueba exacta de Fisher para determinar la relación existente de humanos y bovinos con los serovares encontrados. Los datos se analizaron con el paquete estadístico Epi Info 7.2®, tomando un nivel de significancia estadística de P<0,05.
Consideraciones éticas
Para el desarrollo de la investigación se obtuvo el consentimiento informado de los participantes, siguiendo un procedimiento de toma de muestras en humanos y bovinos revisado y autorizado por el Comité de Ética e Investigaciones de la Universidad Pedagógica y Tecnológica de Colombia.
Resultados y Discusión
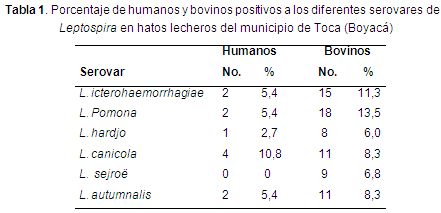
Se realizó un análisis descriptivo para determinar la seroprevalencia de Leptospira spp. Los hallazgos del presente estudio confirmaron la exposición de Leptospira en humanos cuya prevalencia fue de 29,7% (11/37), los cuales fueron positivos a varios serovares, siendo sejroë el único serovar que se encontró negativo en humanos (Tabla 1). Este resultado fue similar al encontrado en trabajadores de las plantas de beneficio en Boyacá, donde se evidenció la presencia del patógeno en un 35%, y los individuos se encontraban sanos, sin signos consistentes con la infección (Pedraza et al., 2012), confirmando que existe una exposición a la enfermedad en trabajadores asociados con el área agropecuaria del departamento. Otros estudios realizados en Colombia, han reportado prevalencias del 23,3% en Cali (1:800) (Astudillo et al., 2009), 20,6% en barrios periféricos de Cali (1:50) (Ferro et al., 2006), mientras que en Córdoba y Antioquia se realizó la detección de anticuerpos IgM anti-Leptospira encontrando 13,1% (Nájera et al., 2009) y 14,1% (Arroyave et al., 2013) respectivamente. Lo anterior, permite focalizar poblaciones específicas con seropositividad e idenficar el posible riesgo de leptospirosis en humanos.
Investigaciones en Colombia han reportado la presencia de leptospirosis. En Villavicencio (Meta), se encontró una prevalencia de 21% en ordeñadores de bovinos doble propósito (Góngora et al., 2008), mientras que en Sucre se encontró un 13,3% en personas que se desempeñaban como jornaleros, profesionales del campo y ordeñadores, entre otros, donde este último tuvo mayor prevalencia (6,7%) con respecto a los demás oficios (Ríos et al., 2008). Esto indica que la fuente de infección de los ordeñadores, especialmente, podría provenir del estrecho contacto con la orina y leche de los animales infectados, debido a que la transmisión se puede realizar a través del contacto directo o indirecto con mucosas o piel lesionada, resaltando la escasa protección que usan los trabajadores al momento del ordeño. Sin embargo, este resultado obtenido en Sucre es bajo posiblemente porque usaron ELISA IgM como técnica diagnóstica que posee menor sensibilidad que la ténica de MAT usada en el estudio en Toca, la cual posee mayor sensibilidad y especificidad para el diagnóstico de leptospirosis (Swapna et al., 2006).
El serovar de mayor prevalencia en humanos fue canicola con 10,8%, seguido de los serovares icterohaemorrhagiae, pomona y autumnalis con una prevalencia de 5,4% para cada uno, similar a un estudio realizado en la región del Urabá antioqueño colombiano, donde se encontró en humanos la presencia de los serovares pomona, icterohaemorrhagiae y canicola, estos dos últimos asociados con la presencia de roedores y caninos (Agudelo-Flórez et al., 2007). De igual forma en Bogotá D.C., en el Centro de Zoonosis, el serovar de mayor prevalencia en humanos fue canicola, seguido de copenhageni, australis y pomona, tal como los serovares identificados en este estudio (Gallego et al., 2008). Dichos estudios no fueron realizados con población en riesgo ocupacional, sino en población urbana, sin embargo, registran la exposición de serovares asociados a la presencia de caninos y roedores.
Si bien no se cuenta con otros estudios realizados en el municipio de Toca o en comunidades rurales del departamento de Boyacá para conocer el estado previo de la enfermedad, es claro que el índice de seroreactividad a Leptospira interrogans en esta zona es bastante alto, lo cual es motivo de alerta, ya que esta patología en humanos carece de elementos diagnósticos inmediatos que permitan confirmar la presencia de la enfermedad una vez que se sospecha y su diagnóstico diferencial se hace difícil, ya que en ocasiones cursa de forma asintomática o puede ser confundida con otras patologías que poseen cuadros febriles similares (Naotunna et al., 2016).
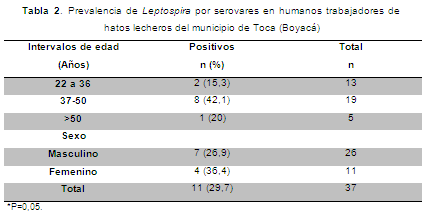
Se establecieron intervalos de edad entre las personas estudiadas. En el grupo 1 (22 a 36 años) se encontraron los serovares pomona y autumnalis, en el grupo 2 (37-50 años) se encontraron icterohaemorrhagiae, pomona, hardjo, canicola y autumnalis, en el grupo 3 (>50 años) se encontró el serovar sejroë (Tabla 2).
En el género femenino se encontró una prevalencia de 36,3% con los serovares pomona 18,2%, canicola y hardjo con 9,1%, mientras que en el género masculino se encontró una prevalencia de 26,9% con tres serovares: icterohaemorrhagiae 7,7%, canicola 11,5% y autumnalis 7,7%. El serovar encontrado en ambos géneros fue canicola.
Se encontró una ligera diferencia en la prevalencia de leptospirosis según el género de los trabajadores que participaron, siendo mayor en los hombres del estudio, lo que concuerda con Johnson et al. (2004) y Agudelo-Flórez et al. (2007), quienes han encontrado que los hombres tienen mayor prevalencia debido a los trabajos específicos del género que desempeñan. Sin embargo, algunos estudios en Colombia demuestran que la seroprevalencia de la enfermedad es similar en hombres y mujeres. Lo anterior, debido a que los trabajos que se derarrollan en el área rural son similares, y en el caso de las explotaciones lecheras del departamento de Boyacá las mujeres desarrollan actividades del mismo nivel que los hombres y juegan un papel muy importante en la economía rural, lo que ha llevado a las mujeres a este tipo de exposición natural a la enfermedad.
El serovar de mayor importancia en mujeres fue pomona y en hombres canicola, este último encontrado en ambos géneros. Estos resultados difieren con un estudio en Colombia donde el serovar de mayor reactividad fue icterohaemorrhagiae. Los resultados obtenidos en este trabajo concuerdan con otros estudios realizados respecto a la presencia de la enfermedad en cuanto a género y edad de los humanos (Astudillo et al., 2009), sin embargo, los hombres jóvenes padecen la enfermedad con mayor frecuencia debido a la exposición que se presenta (Naotunna et al., 2016).
La prevalencia en bovinos de Toca fue del 54,2% (64/133), encontrándose seropositividad de todos los serovares estudiados. En contraste, un estudio realizado en la zona andina del país registra una prevalencia del 60,9% en bovinos en producción (Ochoa et al., 2000), lo cual representa un cifra elevada y confirma la circulación de la bacteria en las producciones bovinas de la región, indicando que existen las condiciones adecuadas para la presencia de la bacteria y una exposición natural a esta, la cual podría significar en algún momento un cambio en la situación epidemiológica generada a partir de individuos susceptibles, evidenciando el riesgo que existe por la circulación de serovares entre las especies, incluyendo al hombre que se encuentra en estrecho contacto con estas.
En otros países, como México, la prevalencia de leptopirosis en bovinos es del 31,1% (Moles et al., 2002), en Venezuela 48% (Alfaro et al., 2004) y en Nigeria 10,98% (Ochefije et al., 2012), demostrando la existencia y circulación de la enfermedad en diferentes países. Entre tanto, los serovares de mayor prevalencia en bovinos fueron pomona (13,5%) y icteroahemorrhagiae (11,3%), resaltando la importancia de este último en la salud humana y animal, canicola (8,3%), autumnalis (8,3%), sejroë (6,8%) y por último hardjo (6,05%). Sin embargo, la prevalencia de cada serovar difiere en gran medida de la zona donde se realice el estudio. En países como México los serovares hardjo, wolffi y tarassovi ocupan los primeros lugares de seroprevalencia (Moles et al., 2002).
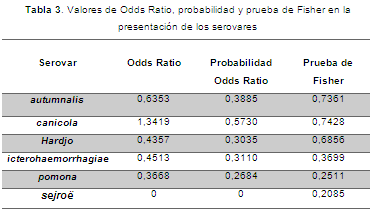
Mediante la prueba de Fisher se determinó que no existía asociación entre el paciente y el serovar (P≥0,05) (Tabla 3), es decir, que los diferentes serovares se pueden presentar tanto en bovinos como en humanos, esto puede deberse al mayor contacto entre los bovinos y elementos contaminados por orina o secreciones de animales silvestres, roedores o caninos, todos ellos en una condición ya sea de portadores, enfermos o convalecientes. Además, se encontró que tanto humanos como bovinos tienen 1,3 veces más probabilidad de presentar el serovar canicola, con respecto a los otros serovares donde el valor de Odds Ratio fue menor a 1. Cabe resaltar que este serovar fue el más prevalente en humanos, lo cual haría pensar en la probabilidad de contagio por medio de secreciones de perros presentes en las fincas, pues ellos representan un reservorio natural (Pulido-Villamarín et al., 2014). Esta afirmación contrasta con la determinación de la actividad ganadera como uno de los mayores factores de riesgo a leptospirosis asociada al serovar hardjo, dado que el ganado es su hospedador de mantenimiento (Dechner, 2014). En cuanto al serovar sejroë, no se pudo establecer ningún tipo de asociación, debido a que los humanos fueron negativos al serovar.
Conclusiones
Los resultados demuestran la presencia de Leptospira spp. y la exposición a distintos serovares en animales y humanos, resaltando el riesgo que puede representar el desarrollo de labores pecuarias sin medidas de protección laboral. Se destaca la importancia de realizar investigaciones más avanzadas, con el fin de entender la epidemiología de la leptospirosis en la región, debido a que falta claridad y además existe amenaza de una mayor adaptación de esta en el medio debido a las condiciones climáticas de la zona; resaltando la influencia de los cambios climáticos globales, que son factores predisponentes para enfermedades endémicas e incluso pandémicas.
Agradecimientos
A la Secretaría de Salud de Boyacá por su aporte económico para la realización de este proyecto, y a la ingeniera Zoraida Cruz por sus valiosos aportes y su colaboración desde el inicio del proyecto hasta su fase final.
Referencias bibliográficas
Cómo citar: Pulido-Medellín, M.; Díaz-Anaya, A.; Giraldo-Forero, J. Determinación de Leptospira spp. en humanos y bovinos pertenecientes al municipio de Toca, Boyacá. Revista Veterinaria y Zootecnia, v.11, n.2, p.55-66, 2017. DOI: 10.17151/vetzo.2017.11.2.5
Esta obra está bajo una Licencia de Creative Commons Reconocimiento CC BY
|