|
Presencia de anticuerpos contra Leptospira interrogans (sensu lato) en caninos semidomésticos en Sincelejo, Sucre (Colombia)
ARTÍCULO DE INVESTIGACIÓN
Germán Arrieta-Bernate
1Grupo Salud Pública y Auditoría en Salud. Corporación Universitaria del Caribe (CECAR), Sincelejo. 2Instituto de Investigaciones Biológicas del Trópico (IIBT). Facultad de Medicina Veterinaria y Zootecnia. Universidad de Córdoba. 3Grupo de Investigaciones Microbiológicas y Biomédicas de Córdoba (GIMBIC), Programa de Bacteriología, Universidad de Córdoba. 4Instituto de Investigaciones Biológicas del Trópico (IIBT). Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba.
This email address is being protected from spambots. You need JavaScript enabled to view it.
(Recibido: 22 de Febrero de 2016 Aprobado: 17 Agosto de 2016 Actualizado 28 de 2016)
DOI: 10.17151/vetzo.2016.10.1.7
RESUMEN: La leptospirosis es una zoonosis reemergente de distribución mundial causada por espiroquetas patógenas del género Leptospira. Ha sido catalogada como una enfermedad ocupacional; su presentación está relacionada con una serie de factores epidemiológicos que resaltan la presencia de animales portadores (roedores, caninos) y la calidad del agua entre otros. El objetivo fue determinar la seroprevalencia de anticuerpos contra L. interrogans (sensu lato) en caninos semidomésticos del área urbana de Sincelejo, Sucre. Mediante un diseño no probabilístico de conveniencia, se escogieron tres comunas con el mayor número de caninos. Se tomaron muestras de sangre de 61 caninos, que se identificaron, posteriormente se obtuvo el suero y se implementó la prueba de la microaglutinación (MAT) con 11 serogrupos y 14 serovares. La seroprevalencia de anticuerpos contra L. interrogans (sensu lato) fue del 54,10%. El 9,84% de los caninos presentaron títulos bajos, el 8,19% títulos moderados, el 13,11% títulos altos y el 22,95% títulos muy altos. No se presentaron diferencias significativas entre las serorreactividades cuando se compararon por sexo, edad y raza. El serovar Grippotyphosa fue el que presentó la mayor frecuencia (47,54%) seguido del serovar Canicola (26,23%) y del serovar Pomona (18,03%). Estos resultados sugieren que estos caninos semidomésticos evaluados, han exhibido infecciones asintomáticas con diferentes serovares de L. interrogans (sensu lato) y se constituyen en hospederos y portadores renales, convirtiéndose en un riesgo potencial en salud pública.
Palabras clave: espiroquetas, hospedero, infección, perros, zoonosis
Presence of antibodies against Leptospira interrogans (sensu lato) in semi-domestic dogs in Sincelejo, Sucre (Colombia).
ABSTRACT: Leptospirosis is a reemerging zoonosis of worldwide distribution caused by pathogenic spirochetes of the genus Leptospira. This disease has been classified as an occupational disease and its presentation is related to a series of epidemiological factors which highlight the presence of carrier animals (rodents, dogs) and water quality, among others. The objective of this work was to determine the seroprevalence of antibodies against L. interrogans (sensu lato) in domestic dogs of the urban area in Sincelejo, Sucre. Using a non-probabilistic convenience design, three communes were selected with the greatest number of canines. Blood samples of 61 identified dogs were taken, and serum was obtained later and the microagglutination test (MAT) was implemented with 11 serogroups and 14 serovars. The seroprevalence of antibodies against L. interrogans (sensu lato) was 54.10%. A 9.84% of the dogs have low titers, 8.19% moderate titers, 13.11% high titers and 22.95% very high titers. No significant differences between seroreactivity are shown when compared by sex, age and breed. The Grippothyphosa serovar presented the greatest frequency (47.54%) followed by Canicola serovar (26.23%) and Pomona serovar (18.03%). These findings suggest that these semi-domestic dogs evaluated have shown asymptomatic infections with different serovars of L. interrogans (sensu lato) becoming hosts and kidney carriers thus constituting a potential risk to public health.
Key words: dogs, host, infection, spirochaetales, zoonoses.
Introducción
La leptospirosis es una enfermedad zoonótica reemergente de distribución mundial y de comportamiento endémico, de mayor presentación en países tropicales y subtropicales (Bharti et al., 2003). Se transmite principalmente por contacto con orina y fluidos de animales infectados (Fearnley et al., 2008). Los reservorios suelen ser animales domésticos o salvajes que tienen la capacidad de ser hospederos primarios o accidentales, dependiendo del serovar, lo que predispone la necesidad de conocimiento de los serovares de cada región, con el fin de comprender mejor la epidemiología de cada zona (Levett, 2001).
La leptopirosis es producida por Leptospira interrogans (sensu lato), que son espiroquetas, donde se han identificado más de 230 serovares patógenos (Adler et al., 2011); estas espiroquetas pueden sobrevivir durante meses en aguas estancadas o corrientes de curso lento, de reacción neutra o ligeramente alcalina, al abrigo de la luz solar directa (Vijayachary et al., 2008). En aguas superficiales en la Amazonia peruana se reportó un 67,9% de positividad a L. interrogans (sensu lato) por la reacción e cadena de la polimerasa o PCR (Ganoza et al., 2006). Se ha reportado como una infección recreacional por la transmisión en nadadores que participaron en la travesía Eco-challenge en Borneo (Malasia), donde presentaron cuadros febriles y una evidencia serológica del 54% de infección con Leptospiras patógenas (Sejvar, 2003); los cultivos de arroz también pueden ser origen de una infección (Roca, 2006).
La infección en humanos es el resultado de la exposición directa o indirecta con la orina de mamíferos infectados; las tres vías principales de riesgo de trasmisión son: aguas, roedores y animales de granja o mascotas (Levett, 2001); los humanos son considerados como hospederos finales y altamente susceptibles a la infección con muchos serovares (Smith et al., 2011).
Los roedores son el principal reservorio en ambientes urbanos y fueron los primeros en ser reconocidos como portadores de L. interrogans (sensu lato) y han sido relacionados con infección en humanos (Vijayachary et al., 2008). Son reservorios primarios para el serovar Icteohaemorrhagiae y accidentales parael serovar Pomona (Dammert, 2005). Los caninos son hospederos definitivos del serovar Canicola y su patogenicidad está bien reconocida, pero también son hospederos accidentales de los serovares: Pomona, Grippotyphosa, Bratislava, Bataviae, Ballum, Autumnalis, Hardjo y Australis (Collares, 2005); presentan un mayor grado de exposición que los humanos, ya que tienen libre acceso a ambientes contaminados, cazan ratas y frecuentemente sus alimentos o aguas están contaminados con orina de ratas (Martins et al., 2012) y pueden ser una especie centinela de exposición en humanos (Moore et al., 2006).
Los signos clínicos y la gravedad de la enfermedad son muy variables en los caninos. Los primeros signos clínicos, son a menudo inespecíficos y las mucosas pueden presentar hiperemia conjuntival, sintomatología que puede progresar y presentar signos de enfermedad renal y aborto en hembras. Otras veces, pueden aparecer signos más severos como el síndrome hemorrágico, donde en las etapas finales hay epistaxis, gastroenteritis hemorrágica. Algunos caninos presentan muerte súbita sin signos clínicos. La infección por el serovar Icterohaemorrhagiae produce fiebre, hemorragias, anemia e ictericia, por el serovar Grippotyphosa puede producir disfunción renal aguda o hepatitis activa crónica, por el serovar Pomona la infección es asintomática y produce portadores crónicos y por el serovar Canicola causa nefritis intersticial crónica (CFSPH, IICAB, 2005).
Los caninos infectados también pueden morir sin presentar signos clínicos (leptospirosis hiper-aguda), otros enfermar con recuperación clínica lenta, tornándose portadores renales por meses, incluso años (leptospiruria) y constituyéndose en un riesgo potencial de trasmisión para otros animales y el hombre (Levett, 2001; Huerta et al., 2013). El objetivo general fue determinar la seroprevalencia de L. interrogans (sensu lato) en caninos en Sincelejo, Sucre (Colombia).
Materiales y Métodos
Tipo de estudio: descriptivo de corte transversal.
Zona de estudio: el proyecto se implementó en tres comunas con el mayor número de caninos en Sincelejo (Sucre), ubicada al noroeste de Colombia, en la costa Caribe colombiana, a 9º 18' LN y 75º 23' LO, con una extensión de 28.134 hectáreas y una altura de 213 msnm.
Cálculo y tamaño de la muestra: mediante un diseño no probabilístico (Hernández et al., 2000; Moreno et al., 2000), se escogieron las tres comunas con el mayor número de caninos y se determinó que el tamaño de la muestra fue de 60 caninos; se tomaron 20 caninos en cada comuna; independientemente de las características fenotípicas y genotípicas. Estos caninos fueron considerados como semidomésticos, ya que los propietarios permiten que pasen deambulando por las calles durante muchas horas del día.
Toma de muestra de sangre y orina: para la toma de las muestras se amplió el número y se muestrearon 61 caninos, los cuales fueron sedados con acetilpromacina (1,1 a 2,2 mg/kg de peso corporal), seguidamente se hizo asepsia con alcohol antiséptico al 70%, sobre la vena yugular o cefálica y se extrajeron 4 mililitros de sangre en tubos vacutainer sin anticoagulante. Las muestras se identificaron y se conservaron en refrigeración, hasta el Instituto de Investigaciones Biológicas del Trópico (IIBT) de la Universidad de Córdoba; allí se centrifugaron a 3.000 gravedades durante 5 minutos para obtener el suero y una vez obtenidos fueron almacenados en tubos Eppendorf a -70ºC, hasta su procesamiento.
Prueba de microaglutinación (MAT): la detección de anticuerpos frente a L. interrogans (sensu lato), se hizo mediante la prueba de microaglutinación (MAT), de acuerdo con las especificaciones de la Organización Mundial de la Salud (OMS, 2008), con 11 serogrupos y 14 serovares: serogrupo Australis (serovar Bratislava), serogrupo Autumnalis (serovar Autumnalis), serogrupo Batavie (serovar Batavie), serogrupo Serjoe (serovar Hardjo), serogroupo Grippotyphosa (serovar Grippotyphosa), serogrupo Icterohaemorrhagiae, (serovar Icterohaemorrhagiae), serogrupo Mini (serovar Mini), serogrupo Pomona (serovar Pomona), serogrupo Pyrogenes (serovar Zanoni), serogrupo Tarassovi (serovar Tarassovi) y serogrupo Canicola (serovar Canicola). Los títulos ≥1:100 se consideraron como positivos.
Métodos de instrumentos de recopilación de datos y diseño estadístico: las variables generales sobre la identificación de los caninosse tabularon en una tabla de Excel. Una vez procesadas las muestras, se analizaron los niveles de anticuerpos para determinar la presencia o ausencia de anticuerpos contra L. interrogans (sensu lato), los resultados de laboratorio y las variables cualitativas se analizaron por estadística descriptiva, mediante el software SAS.
Aspectos éticos: el Comité de Ética del IIBT de la Universidad de Córdoba, clasificó este estudio de bajo riesgo. Las muestras fueron tomadas por un médico veterinario zootecnista, quien efectuó los procedimientos de la toma de las muestras teniendo en cuenta los procedimientos de manejo y conservación, las normas éticas, técnicas, científicas y administrativas para la investigación en animales, según la Ley 84 o Estatuto de Protección Animal de la República de Colombia (Congreso de Colombia, 1989).
Resultados y Discusión
Se analizaron 61 sueros de caninos; el 68,85% (42/61) fueron machos y el 31,15% (19/61) hembras; en la comuna 4 se recolectaron el 34,43% (21/61) de las muestras, en la comuna 6 el 34,43% (21/61) y en la comuna 8 el 31,14% (19/61). Dentro de los datos anamnésicos evaluados, se determinó que solamente en el 73,7% (45/61) de los caninos hubo evidencias de vacunación periódica contra la rabia y los propietarios manifestaron que nunca han vacunado sus caninos contra la leptospirosis.
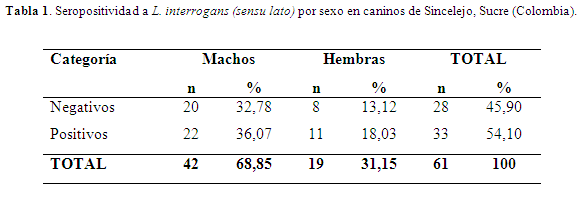
La seroprevalencia de anticuerpos contra L. interrogans (sensu lato), al considerar como positivo un título ≥ 100 de cualquier serovar, fue del 54,10% (33/61) con un intervalo de confianza del 95% (41, 6-66,6%). Por los anamnésicos evaluados, estos títulos corresponden a procesos infecciosos previos o recientes (de acuerdo con el título presentado) y no corresponden a títulos post vacunales debido a la ausencia de historial de vacunación contra la leptospirosis. La seroprevalencia por sexo pude verse en la tabla 1. Esta mayor seroprevalencia determinada en el actual estudio (54,10%), es superior al 27,3% en caninos urbanos de Montería (Navarrete et al., 1981), del 12% en caninos de áreas rurales de Montería donde implementaron el MAT con 11 serovares (Sánchez et al., 2010), del 47,14% con 14 serovares en caninos de una comunidad rural de Ciénaga de Oro (Álvarez et al., 2011) y del 35,2% en caninos de granjas porcinas del medio Sinú (Calderón et al., 2014); el uso de un mayor número de antígenos dentro de la batería diagnóstica del MAT, puede aumentar la probabilidad de identificar más serorreactores. Igualmente, al ser considerados como caninos semidomésticos, hacen que recorran zonas donde hay condiciones favorables para el mantenimiento de Leptospiras patógenas, el contacto con otros hospederos como de ratas, la deficiente recolección, acumulación y eliminación inadecuada de las basuras.
Seroprevalencias menores en caninos han sido reportadas en diferentes regiones de Colombia por ejemplo; del 41,1% en caninos callejeros en Cali (Rodríguez et al., 2004), del 31% en Buenaventura con 18 serovares (Romero et al., 2009), del 20,2% en caninos de tres municipios del norte del Tolima con seis serovares (Romero y Sánchez, 2009), del 21,4% en zonas urbanas del Tolima empleando cinco (Romero et al., 2010), e inferior al 67,2% con seis serovares en caninos de Tunja (Bermúdez et al., 2010). Estos reportes evidencian la amplia distribución de la leptospirosis en caninos en diferentes regiones de Colombia y se constituyen en un riesgo potencial para la salud pública porque además de esta enfermedad, pueden hospedar otros patógenos como: Toxoplasma, Brucella (Rivera et al., 1999; Martin et al., 2002; De Paula et al., 2013 Furtado et al., 2015). Igualmente, la presencia de caninos vagabundos, el contacto con roedores, la deficiente recolección, acumulación , y , eliminación inadecuada de las basuras y la carencia de drenajes de aguas estancadas hacen que se aumente el riesgo de infección (Huerta et al., 2013), porque estos factores crean microambientes favorables para la supervivencia de las diferentes especies de Leptospiras (Martin et al., 2002). Se propone que una alta prevalencia de leptospirosis en roedores y caninos en una región, pueden ser fuentes de transmisión e infecciones en los humanos, ya que los caninos infectados pueden infectar a los humanos por el estrecho contacto de estas mascotas con el hombre (Patil et al., 2014; Roqueplo et al., 2015).
No se presentaron diferencias significativas entre las serorreactividades cuando se compararon por sexo (P≥0,05); esta mayor seroprevalencia o serorreactividad en machos se puede deber a que este fue el mayor género muestreado, igualmente por el hábito que poseen los machos durante el período de celo de la hembra como el olfateo, lengüeteo de los genitales (Luna et al., 2008) o la preferencia de los propietarios de preferir más a los machos (Herrer et al., 1958). La categoría sexo (hembra) fue determinada como un factor de protección en un estudio previo, ya que exhibieron casi la mitad del riesgo (OR= 0,6; P<0.05) de presentar infección con relación a los machos (Huerta et al., 2013).
Seropositividad por edad y raza
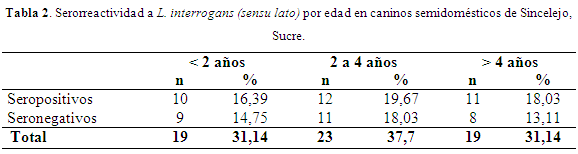
En la tabla 2 se discrimina la serorreactividad por edad; no hubo diferencias significativas entre las serorreactividades cuando se compararon por edad (P≥0,05); esta mayor serorreactividad en el grupo de 2 a 4 años, puede deberse a que este grupo etáreo aportó el mayor número de caninos a la muestra. Igualmente, a medida que aumenta la edad hay mayor posibilidad de que los caninos se infecten por el excesivo contacto entre estos cuando vagan por las calles (Batista et al., 2005; Ward et al., 2002; Ward et al., 2004; Huerta et al., 2013); sin embargo, este riesgo puede aumentar en sitios de confinamiento (criaderos) donde la trasmisión puede ocurrir de progenitores a crías (Huerta et al., 2013).
En un estudio para determinar los factores de riesgo no se encontraron diferencias significativas en relación al sexo, procedencia (rural/urbano), raza, animales vacunados y no vacunados, pero sí entre la categoría de caninos vagabundos y la probabilidad de contraer la enfermedad (Silva & Rediman, 2007). La clasificación de los caninos como semidomésticos en el actual estudio pudo aumentar la probabilidad de infección, ya que estos permanecieron vagando por las calles durante varias horas del día. En Temuco (Chile) se observó que los casos positivos se concentraron dentro del grupo de 5 a 8 años independiente del sexo (Tuemmers et al., 2013).
Este estudio determinó una mayor seroprevalencia en caninos mestizos por ser este el grupo racial que aportó el mayor número de individuos. No se ha determinado que la raza sea un factor determinante, pero el tamaño de la raza sí es un factor de riesgo, por ejemplo, caninos de razas de tamaños grandes han mostrado mayores serorreactividades en comparación con razas de tamaños pequeños, ya que estos últimos por ser más consentidos, estar en mayor contacto con los amos y permanecer más tiempo en las casas, han presentado menores serorreactividades (Huerta et al., 2013); también razas más pequeñas presentaron una menor seropositividad al serovar Copenhageni (Harland et al., 2013).
Serorreactividad por serovar
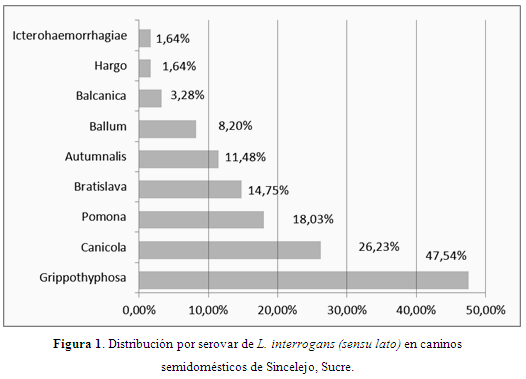
Los caninos son susceptibles a todos los serovares conocidos de L. interrogans (Jouglard & Brod, 2000); el serovar Grippotyphosa fue el que presentó la mayor frecuencia (47,54%) seguido del serovar Canicola (26,23%) y del serovar Pomona con 18,03% (Figura 1).
En Colombia, los serovares más frecuentes en caninos han sido: Icterohaemorrhagiae, Canicola, Grippotyphosa, Pomona, Hardjobovis, Hardjoprajitmo, Automnalis, Sejroë y Tarassovi (Navarrete et al., 1981; Bermúdez et al., 2010; Rodríguez et al., 2004; Romero et al., 2009; Sánchez et al., 2010; Romero et al., 2010; Bermúdez et al., 2010; Calderón et al., 2014). En caninos de la Sabana de Bogotá con falla renal, determinaron que los serovares más frecuentes fueron Icterohaemorrhagiae, Canicola y Ggrippotyphosa (Medrano et al., 2011).
Los serovares Grippotyphosa y Pomona son específicos de bovinos y porcinos y han sido reconocidos como reemergentes en la leptospirosis canina (Ribotta et al., 2000). Grippotyphosa fue más frecuente (47,7%) en caninos callejeros en Cali (Rodríguez et al., 2004) y en zonas urbanas y rurales del Tolima (Romero et al., 2010). Grippotyphosa ha sido asociado a ratas y roedores (McDonough, 2001). En caninos y humanos en Ixhuatlancillo, Veracruz (México), el serovar más predominante fue Tarassovi (Lugo et al., 2015).
Cuando se discriminó la serorreactividad por el número de serovares, se observó que el 10,01% de las infecciones se dio por un solo serovar, el 15% por dos serovares, el 4,24% por tres serovares, el 16,17% por cuatro serovares y el 8,68% por más de cinco serovares. Los patrones de coaglutinación más frecuentes de los serovares fueron: Grippotyphosa-Canicola y Grippotyphosa-Pomona. El patrón de los serovares Grippotyphosa-Canicola fue el más frecuente reportado en Cali en caninos callejeros (Rodríguez et al., 2004) y el patrón de los serovares Icterohaemorrhagiae–Grippotyphosa en caninos de áreas rurales de Ciénaga de Oro (Álvarez et al., 2011). El patrón de los serovares Grippotyphosa-Pomona ha sido reportado en caninos del norte del Tolima (Romero et al., 2010). Estas reacciones cruzadas entre serovares han sido ampliamente reconocidas y se explican por la presencia de antígenos compartidos entre serovares y serogrupos (Levett, 2001).
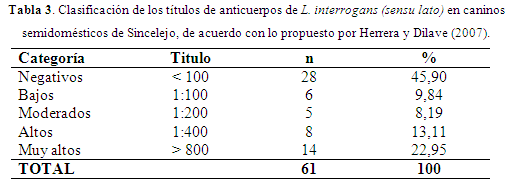
El MAT es considerado como la prueba de referencia para el diagnóstico de la Leptopspirosis y esta prueba determina la presencia de anticuerpos aglutinantes tipo IgM e IgG (Niloofa et al., 2015). Como sólo se hizo un muestreo y se analizó el valor de los títulos serológicos, y teniendo en cuenta que ningún propietario manifestó que los caninos no fueron vacunados contra la leptospirosis; el 45,90% de los caninos no presentaron ningún título para los 14 serovares evaluados; el 9,84% presentaron títulos bajos que pueden corresponder a casos sospechosos o infecciones ocurridas en el pasado; el 8,19% a títulos moderados que se pueden relacionar con el inicio de infección; el 13,11%, títulos altos que tal vez podrían corresponder con infecciones probables y en el 22,95% de los caninos evaluados, títulos muy altos que se pueden interpretar como infección activa o casos agudos de leptospirosis (Tabla 3). Estos posibles casos en los que los títulos fueron altos pueden ser que los caninos eliminen el microorganismo por la orina (leptospiruria) y podrían infectar otros hospederos.
Conclusiones
Estos resultados sugieren que las poblaciones semidomésticas de caninos pueden ser hospederos o reservorios de leptospirosis y constituirse en un riesgo para la salud humana porque pueden trasmitir leptospirosis. Se hace necesario adelantar más estudios de seguimiento seroepidemiológico, de caracterización e impelementar aislamientos de los diferentes serovares de L. interrogans (sensu lato) en reservorios animales y humanos, donde podamos conocer las posibles fuentes de infección y el rol de los diferentes hospederos, con el fin de implementar programas de control y prevención.
Agradecimientos
Los autores agradecen la la Corporación Universitaria del Caribe y a la Universidad de Córdoba por la financiación del proyecto “Seroprevalencia de Leptospira spp. en caninos callejeros de la ciudad de Sincelejo” – Contrato 02-2013. Este manuscrito fue preparado y revisado con la participación de todos los autores, quienes declaramos que no existe ningún conflicto de intereses que pongan en riesgo la validez de los resultados presentados.
Referencias bibliográficas
Adler, B.M.; Seemann, L.T.; Murray, G.L. Pathogenesis of leptospirosis: the influence of genomics. Vet Microbiol, v.153 ,(1-2):p. 73-81, 2011.
Álvarez, L.; Calderón, A.; Rodríguez, V.; Arrieta, G. Seroprevalencia de leptospirosis canina en una comunidad rural del municipio de Ciénaga de Oro, Córdoba (Colombia). Rev. U.D.C.A Act. & Div. Cient, v.14, n.2, p.75-81, 2011.
Batista, C.S.A.; Azevedo, S.S.; Alves, C.J.; Vasconcellos, S.A.; Morais, Z.M.; Clementino, I.J.; Lima, S.F.; Neto, A.J.O. Soroprevalência de leptospirose em cães errantes da cidade de Patos, Estado da Paraíba, Brasil. Braz. J. Vet. Res. Anim. Sci, v.41, n.2, p. 131-136, 2004.
Bermúdez, C.S.; Pulido, M.; Andrade, R. Seroprevalencia de Leptospira spp. en caninos y humanos de tres barrios de Tunja, Colombia. Rev. MVZ Córdona, v.15, n.3, p. 2185-2193, 2010.
Bharti, A.R.; Nally, J.E.; Ricaldi, J.N.; Matthias, M.A.; Díaz, M.M.; Lovett, M.A.; Levett, P.N.; Gilman, R.H.; Willig, M.R.; Gotuzzo, E.; Vinetz, J.M. Leptospirosis: a zoonotic disease of global importance. Lancet Infect Dis, v.3, p.757-771, 2003.
Calderón, A.; Rodríguez, V.; Mattar, S.; Arrieta, G. Leptospirosis in pigs, dogs, rodents, humans, and water in an area of the Colombian tropics. Tropc Anim Health Prod, v.46, p. 427-432, 2014.
Center for Food Security & Pubic Health. (CFSPH). Intitute for International Coopertion in Animal Biologics (IICAB). Iowa State University. Leptospirosis. 2005. Disponible en: <http://www.cfsph.iastate.edu/Factsheets/es/leptospirosis-es.pdf> Accesado en: 14/12/2015.
Collares, P.M.; Mathias, M.L.; Santos, R.M.; Ramalhinho, M.G.; Duarte, R.P. Rodents and Leptospira transmission risk in Terceira Island (Azores). Eur J Epidemiol, v. 16, n.12, p.1151-1157, 2000.
Congreso de Colombia. 1989. Estatuto Nacional de Protección Animal. Ley 84 de 1989. Por la cual se adopta el Estatuto Nacional de Protección de los Animales y se crean unas contravenciones y se regula lo referente a su procedimiento y competencia. Disponible en: <http://spac-05.tripod.com/id24.html> Accesado en: 03/03/2011).
Dammert, N. Leptospirosis: una revisión bibliográfica. 2005. Disponible en: <http://www.sapuvetnet.org/Pdf%20Files/Monografia_leptospira.pdf> Accesado en: 14/12/2015.
De Paula, D.M.K.; Gonçalves, D.D.; da Silva, C.I.C.; Gerônimo, E.; Menegas, P.H.; Bergo, D:, Ruiz, L.M.F.M.; Benitez, A.; de Freitas, J.C.; Evers, F.; Navarro, I.T.; Martins, L.A. Toxoplasmosis, leptospirosis and brucellosis in stray dogs housed at the shelter in Umuarama municipality, Paraná, Brazil. J Venom Anim Toxins incl Trop Dis, v.19, p.23, 2013.
Fearnley, C.; Wakeley P.R, Gallego, B.J.; Dalley, C.; Williamson. S.; Gaudie, C.; Woodward, M.J. The development of a real-time PCR to detect pathogenic Leptospira species in kidney tissue. Res Vet Sci, v.85, n,1, p.8-16, 2008.
Furtado, M.M.; Gennari, S.M.; Ikuta, C.Y.; Jácomo, A.T.; de Morais, Z.M.; Pena, H.F.; Porfírio, G.E.; Silveira, L.; Sollmann, R.; de Souza, G.O.; Tôrres, N.M.; Ferreira, N.J.S. Serosurvey of smooth Brucella, Leptospira spp. and Toxoplasma gondii in free-ranging Jaguars (Panthera onca) and domestic animals from Brazil. PLoS One. 2015 Nov 25;10(11):e0143816. doi: 10.1371/journal.pone.0143816. eCollection 2015.
Ganoza, C.A.: Matthias, M.A.; Collins, R.D.; Brouwer, K.C.; Cunningham, C.B.; Segura, E.R.; Gilman, R.H.; Gotuzzo, E.; Vinetz, J.M. Determining risk for severe leptospirosis by molecular analysis of environmental surface waters for pathogenic Leptospira. PLoS Medicine, v.3, n.8, p.308, 2006.
Harland, A.L.; Cave, N.J.; Jones, B.R.; Benschop, J.; Donald, J.J.; Midwinter, A.C.; Squires, R.A.; Collins, E. J.M. A serological survey of leptospiral antibodies in dogs in New Zealand. N Z Vet J, v.61, n.2, p.98, 2013.
Hernández, A.M.; Garrido, L.F.; López, M.S. Diseño de estudios epidemiológicos. Salud Pública Méx, v.42, n.2, p.144-154, 2000.
Herrer, A.; Liceras, J.; Meneses, O. Leptospirosis en el Perú. Identificación de las cepas de Leptospira presentes en el perro y el gato e incidencias de la infección. Rev. Méd. Exp, v, 12, p.65-86, 1958.
Huerta, M.C.; Chilón, V.; Díaz, C.D. Estudio de caso-control para evaluar factores de riesgo en la presentación de leptospirosis canina en la ciudad de Lima. Rev Inv Vet Perú, v.24, n.1, p.111-117, 2013.
Herrera, B.; Dilave, R.D.M. 2012. Leptospirosis, interpretación de resultados serológicos en animales. Disponible en: <http://www.produccion-animal.com.ar/sanidad_intoxicaciones_metabolicos/enfermedades_reproduccion/55-interpretacion_leptospira.pdf> Accesado en: 14/12/2015.
Jouglard, S.D.D.; Brod, C.S. Leptospirosis en câes: Prevalence e factores de risco no meio rural do municipio de Pelotas, RS. Arq. Inst. Biol S. Sâo Paulo, v.67, n.2, p.181-185, 2000.
Levett, P.N. Leptospirosis. Clin Microbiol Rev, v.14, p.296-326, 2001.
Lugo, C.B.L.; Velasco, R.L.C.; Canales, V.G.; Velázquez, H.J.F.; Herrera, H.E.V. Detección de anticuerpos anti-Leptospira em una población vulnerable de Ixhuatlancillo, Veracruz. Rev Med Inst Mex Seguro Soc, v.53, n.2, p.158-63, 2015.
Luna, A.M.A,; Moles, C.L.P.; Gavaldón, R.D.; Nava, V.C.; Salazar, G.F. La leptospirosis canina y su problemática en México. Rev. Salud Anim, v30, n.1, p.1-11, 2008.
Martins, G.; Penna, B.; Lilenbaum, W. The dog in the transmission of human leptospirosis under tropical conditions: victim or villain? Epidemiol Infect, v.140, n.2, p.207-208, 2012.
Martin, U.O.; Sensevy, A.; Colombo, J.; Tramontin, V. Leptospirosis en la provincia de Santa fe: Descripción epidemiológica, clínica y socioeconómico. MEDICINA, v.62, n2, p.164-168, 2002.
McDonough, P. 2001. Leptospirosis en caninos - estado actual. Department of Population Medicine and Diagnostic Science, Diagnostic Laboratory, College of Veterinary Medicine, Cornell University, New York (USA). Disponible en: <http://www.ivis.org/advances/infect_dis_carmichael/mcdonough_es/ivis.pdf> Accesado en: 14/12/2015.
Medrano, G.C.; Díaz, R.C.A.; Dalmau, B.EA. Diagnóstico de leptospirosis canina por medio de las técnicas Dot-ELISA y MAT en perros con enfermedad renal en Bogotá. Rev. Med. Vet, v.21, p.133-145, 2011.
Moore, G.; Guptill, L.; Glickman, N.; Caldanaro, R.; Aucoin, D.; Glickman, L. Canine leptospirosis, United States, 2002-2004. Emerg Infect Dis, v.12, n.3, p.501-503, 2006.
Moreno, A.M.; Moreno, L.S.; Corcho, B.A. Principales medidas en epidemiología. Salud Pública Méx, v.42, n..4, p.337-347, 2000.
Navarrete, M.; Sejin, R.; Vélez, P. Estudio preliminar de leptospirosis en caninos en la ciudad de Montería. Revista ICA, v.16, p.165-172, 1981.
Niloofa, R.; Fernando, N.; De Silva, N.L. .; Karunanayake, L.; Wickramasinghe, H.; Dikmadugoda, N.; Premawansa, G.; Wickramasinghe, R.; Janaka de Silva, H.; Premawansa, S.; Senaka Rajapakse, S.; Handunnett, S. Diagnosis of Leptospirosis: Comparison between Microscopic Agglutination Test, IgM-ELISA and IgM Rapid Immunochromatography Test. PLoS One. 2015. 10(6): e0129236. doi:10.1371/ journal.pone.0129236.
Organización Mundial de la Salud (OMS). Leptospirosis humana: Guía para el diagnóstico, vigilancia y control. Traducción del Centro Panamericano de Fiebre Aftosa, Río de Janeiro: Centro Panamericano de Fiebre Aftosa –VP/OPS/OMS, 2008.
Patil, D.; Dahake, R.; Roy, S.; Mukherjee, S.; Chowdhary, A.; Deshmukh, R. Prevalence of leptospirosis among dogs and rodents and their possible role in human leptospirosis from Mumbai, India. Indian J Med Microbiol, v.32, n.1, p.64-67, 2014.
Ribotta, M.; Higgins, R.; Gottschalk, M.; Lallier, R. Development of an indirect enzyme-linked inmunoabsorbent assay for the detection of leptospiral antibodies in dogs. J. Vet. Res. Canada, v.64, p.32-37, 2000.
Rivera, F.A.; De la Peña M.A.; Roa, R.M.; Ordóñez, B,M.L. Seroprevalencia del leptospirosis en perros callejeros del norte de la ciudad de México Vet. Méx, v.30, n.1, p105-107, 1999.
Roca, B. Leptospirosis artículos de revisión. Rev. Med. Uninavarra, v.50, n.2, p.3-6, 2006.
Rodríguez, A.; Ferro, B.; Varona, M. Santafe M. Evidencia de exposición a Leptospira en perros callejeros de Cali. Biomédica, v.24, p.291-295, 2004.
Romero, M.; Astudillo, M.; Quintero, M. Seroprevalencia y serotipificación de leptospirosis canina en el municipio de Buenaventura (Valle del Cauca). Biosalud, v.8, p.71-76, 2009.
Romero, P.M.; Sánchez, V.J. Seroprevalencia de la leptospirosis canina de tres municipios del departamento del Tolima- Colombia. Rev.MVZ Córdoba, v.14, n.2, p.1684-1689, 2009.
Romero, M.; Sánchez, J.; Hayek, L.C. Prevalencia de anticuerpos contra Leptospira en población urbana humana y canina del departamento de Tolima. Rev salud pública, v.12, n.2, p.268-275, 2010.
Roqueplo, C.; Marié, J.L.; André, F.G.; Kodjo, A.; Davoust, B. Serological survey of canine leptospirosis in three countries of tropical Africa: Sudan, Gabon and Ivory Coast. Comp Immunol Microbiol Infect Dis, v.38, p.57-61, 2015.
Sánchez, A.; Ballut, J. C.; Calderón, R.; Rodríguez, V. Leptospirosis: Enfermedad endémica en caninos de áreas rurales de Montería (Córdoba). Revista ORINOQUIA, v.14, n.2, p.160-167, 2010.
Sejvar, J.J.; Bancroft, E.; Winthrop, K.L.; Bettinger, J.; Bajani, M.; Bragg, S.; Shutt, K.; Kaiser, R.; Marano, N.; Popovic, T.; Tappero, J.; Ashford, D.; Mascola, L.; Vugia, D.J.; Perkins, B.; Rosenstein, N.; The Eco-Challenge Investigation Team. Leptospirosis in “Eco-Challenge” Athletes, Malaysian Borneo, 2000. Emerg Infect Dis, v.9, n.6, p.124-129, 2003.
Silva, R.F.; Riedemann, S. Seroprevalencia de leptospirosis canina en perros atendidos en clínicas veterinarias, mediante aglutinación microscópica y comparación con las técnicas de aislamiento e inmunofluorescencia indirecta. Arch. Med. Vet, v.39, n.3, p.269-274, 2007.
Smith, R.M.; Zochowski, W.J.; Palmer, S.; Soulsby, Torgerson P, Bro. Leptospirosis. Oxford Textbook of Zoonoses. 2nd ed. New York, USA: Oxford University Press, 2011.
Tuemmers, C.; Lüders, C.; Rojas, C.; Serr, M.; Espinoza, R.; Castillo, C. Prevalencia de leptospirosis en perros vagos capturados en la ciudad de Temuco, 2011. Rev Chilena Infectol, v.30, n.3, p.252-257, 2013.
Vijayachary, P; Sugunan, A.P.; Shriram, A.N. Leptospirosis: an emerging global public health problem. J Biosci, v.33, n.4, p.557-569, 2008.
Ward, M.; Glickman, L.; Guptill, L. Prevalence and risk factors for leptospirosis among dogs in the United States and Canada: 677 cases (1970-1998). JAVMA, v.220, p.53-58, 2002.
Ward, M.; Guptill, L.; Wu, C. Evaluation of environmental risk factors for leptospirosis in dogs: 36 cases (1997-2002). JAVMA, v.225, p.72-77, 2004.
Cómo citar: Arrieta-Bernate, G.; Calderón-Rangel, A.; Rodríguez, V.; Álvarez, J.; Mattar, S. Presencia de anticuerpos contra Leptospira interrogans (sensu lato) en caninos semidomésticos en Sincelejo, Sucre (Colombia). Revista Veterinaria y Zootecnia, v. 10, n. 1, p. 89-103, 2016. DOI: 10.17151/vetzo.2016.10.1.7
Este obra está bajo una Licencia de Creative Commons Reconocimiento CC BY
|