|
Parásitos intestinales en poblaciones pequeñas y aisladas de Mono aullador rojo (Alouatta seniculus) y Mono araña café (Ateles hybridus), Atelidae – Primates en el Magdalena Medio, Colombia
ARTÍCULO DE
(Recibido: abril 01, 2013 aprobado: mayo 15, 2013)
RESUMEN: Los primates no humanos poseen una alta cantidad y diversidad de parásitos, sin embargo la información en esta área a nivel mundial es escasa e inconsistente. En Suramérica, donde la vigilancia epidemiológica es mínima, es difícil conocer el rol de múltiples parásitos y su dinámica poblacional. En el valle medio del río Magdalena se han reducido las coberturas naturales hasta en un 15% y consecuentemente, alterado la dinámica parásito-hospedero. El objetivo del presente trabajo fue entender el efecto de reducción y fragmentación del hábitat sobre los primates neotropicales. Considerando parámetros sanitarios. Para ello se determinó la prevalencia de parásitos intestinales en el Mono aullador rojo y en el Mono araña café en dos fragmentos de bosque dentro de una matriz de pastos destinados a la ganadería extensiva. El diagnóstico parasitario se realizó empleando técnicas de flotación y observación directa. La prevalencia fue estimada empleando métodos bayesianos. En este estudio de caso, el 75% (21/28) de las muestras fueron positivas a la presencia de formas parasitarias. Se reporta la presencia biológica de formas compatibles con Strongyloides stercoralis, Cryptosporidium parvum y Cyclospora cayetanensis. No se encontraron diferencias significativas entre las poblaciones de los primates de ambos sitios, pero se registra una alta prevalencia de S. stercoralis (27%-59%). La presencia parasitaria sugiere un riesgo potencial a la salud pública y una amenaza para las poblaciones de Atelidos. La reducción y fragmentación de los hábitats, posiblemente aumenta la transmisión parasitaria (animal-animal) asociada a la capacidad de los parásitos de transmitirse, reproducirse y resistir la presión ambiental e inmunitaria de su hospedero.
Palabras clave: nematodos, neotropicales, protozoos, zoonosis
Intestinal parasites in small and isolated population of Red-howler monkey (Alouatta seniculus) and Brown-spider monkey (Ateles hybridus), Atelidae - Primates in the Colombian Magdalena Medio
ABSTRACT: The non-human primates have a huge amount and diversity of parasites; however, the information in this area around the world is scarce and inconsistent. In South America, where there is a minimal epidemiological surveillance, it is difficult to recognize the role of multiple parasites and their population dynamic. In the Valley of Magdalena natural forest coverage has been reduced to 15%, and as a consequence, the parasite-host relation dynamic has been altered. The aim of this study was to understand the effect of habitat reduction and fragmentation on Neotropical primates considering sanitary parameters. For this purpose, the prevalence of intestinal parasites in Red-howler monkeys and in Brown-spider monkeys in two forest fragments within the grassland matrix used for extensive livestock was determined. The diagnosis of parasitic infections was done using flotation techniques and direct observation. The prevalence estimation was done using Bayesian analytic techniques. In this case study 75% (21/28) of the fecal samples were positive to the presence of parasite forms. The biologic presence of forms compatible with Strongyloides stercoralis, Cryptosporidium parvum and Cyclospora cayetanensis was reported. There was no significant difference between primate species in both places, but a high prevalence of Strongyloides stercoralis (27%-59%) is reported. The parasite presence suggests a potential risk to public health and a threat for the Atelidos populations. The habitat reduction and fragmentation probably increases parasite transmission (animal-animal) associated with the parasite capacity to transmit, reproduce and resist environmental pressure and host immunity.
Key words: nematodes, neotropical, protozoa, zoonoses
Introducción
Los microparásitos, bacterias, virus, protozoarios y macroparásitos donde se incluyen los helmintos, hacen parte de procesos naturales que permiten la regulación de las poblaciones y el balance de los ecosistemas (Maizels et al., 1993; Clayton & Moore, 1997). Los parásitos pueden afectar importantes parámetros como las tasas de natalidad y mortalidad (Nunn & Altizer, 2006; Delahay et al., 2009), y algunos modelos matemáticos sugieren que estos podrían cumplir un importante papel en la dinámica poblacional y evolutiva de sus hospederos (Begon et al., 2009; Nunn et al., 2011). Además, como resultado de los cambios antropogénicos en los ambientes naturales, el constante incremento de la población humana y el creciente contacto entre humanos, animales domésticos y silvestres, se ha incrementado la infección parasitaria lo que podría tener un significativo impacto sobre las poblaciones de especies amenazadas (Aguirre et al., 2002; Jones et al., 2008). Impacto que dependerá de las densidades de parásitos, hospederos y de los detalles de la interacción (McCallum, 2000).
La vigilancia epidemiológica permite evaluar parámetros poblacionales y ambientales finos, útiles para tomar medidas de control y prevención de las enfermedades y sus efectos (Morner et al., 2002; Beldoménico, 2013). Particularmente, los primates son un grupo importante para hacer esta vigilancia. Los primates dependen de altos niveles de calidad de hábitat para sostener poblaciones viables y algunas especies son usadas para consumo, experimentación biomédica o como mascotas (Chapman et al., 2005). Por estas razones, los primates son especies altamente susceptibles a la degradación del hábitat y están continuamente en interacción con humanos. Estas interacciones conllevan a un alto y bidireccional riesgo por estar estrechamente emparentadas (Leroy et al., 2004; Sharp & Hahn, 2011).
No obstante, esta vigilancia a escala global ha sido inconsistente y poca. Se estima que en el mundo, podrían haber entre 38% y 79% más especies de parásitos de las reportadas actualmente en las especies mejor muestreadas de primates, y entre un 29% y un 40% en los países con más investigaciones en este grupo. Una de las regiones con particularmente menor esfuerzo de muestreo es Suramérica (Nunn & Altizer, 2006; Cooper & Nunn, 2013). La vigilancia epidemiológica, adicionalmente, contribuiría a entender el preciso rol de los parásitos en las poblaciones que aún es unos de los grandes vacíos en ecología (Delahay et al., 2009).
En la región Andina de Colombia, particularmente en el Valle del río Magdalena se ha transformado cerca del 60% de la cobertura vegetal natural a tierras de pastoreo y cultivos, y del 40% remanente un 60% son bosques en regeneración o de galería (IDEAM, 2010). Por lo anterior muchas de las especies de esta zona están amenazadas (IUCN, 2013). En el caso de los primates, cuatro de las cinco especies que habitan (Mono nocturno caribeño: Aotus griseimembra, Mono araña café: Ateles hybridus, Mono cariblanco: Cebus versicolor y el Mico titi gris: Saguinus leucopus están globalmente amenazadas (de la Torre et al., 2008; Morales & Link, 2008; Morales et al., 2008; Urbani et al., 2008), su hábitat remanente es actualmente de un 15% (Roncancio-Duque et al., 2013) y sus densidades son altamente variables en los sitios en donde aún se encuentran (Aldana et al., 2008; Roncancio Duque et al., 2008; Roncancio et al., 2010, 2011, 2013). Para la otra especie (Mono aullador rojo: Allouatta. seniculus) la población local está seriamente reducida y fragmentada (Roncancio et al., En preparación). Es probable, que adicionalmente a la reducción y fragmentación del hábitat y de la cacería, las enfermedades se hallan convertido actualmente en otra amenaza que está actuando en sinergia con las otras (Aguirre et al., 2002; Jones et al., 2008).
En el marco de los estudios para determinar la distribución y disponibilidad de hábitat actual y las densidades poblacionales de los primates del Magdalena Medio y con el objetivo de empezar a entender el efecto de la reducción y la fragmentación de hábitat en parámetros sanitarios de las poblaciones de primates, se midió la presencia y prevalencia de parásitos intestinales en el Mono aullador rojo y en el Mono araña café en dos fragmentos de bosque que difieren en tamaño, estructura vegetal, en especies y densidad de primates y los cuales están inmersos en una matriz de pastos destinados para ganadería extensiva.
Materiales y Métodos
Área de estudio
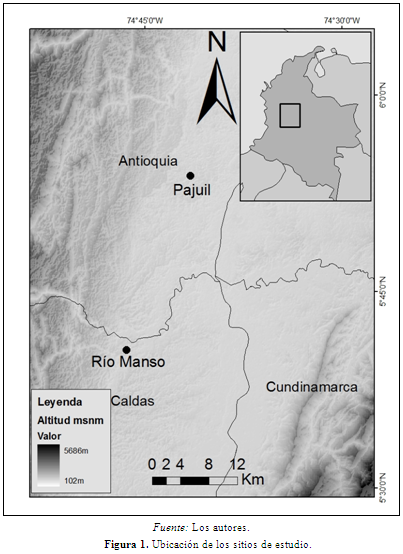
La colecta de muestras se llevó a cabo entre los meses de abril y noviembre de 2009 en dos fragmentos de bosque del Magdalena Medio, Río Manso y El Pajuil. No se realizaron capturas y durante el seguimiento de las poblaciones se tomaron muestras de grupo evitando tomar la muestra del mismo individuo (Valdespino et al., 2010). Río Manso está ubicado en el departamento de Caldas, municipio de Norcasia (5°40’32’’N - 74°46’25’’W), y El Pajuil está ubicado en el departamento de Antioquia, municipio de Puerto Triunfo (05º53’49,6’’N - 74º41’32,8’’W) (Figura 1). Río Manso es un fragmento de bosque denso (IDEAM, 2010) de 330 ha a 212 msnm (DE = 12), con una temperatura media anual de 27ºC (DE = 0) y una precipitación media anual de 2238 mm (DE = 4,25) (Hijmans et al., 2005). El Pajuil es un fragmento de Arbustal de 23,95 ha (IDEAM, 2010), a 192 msnm (DE = 8), con una temperatura media anual de 27ºC (DE = 0) y una precipitación media anual de 2314 mm (DE = 0,65) (Hijmans et al., 2005). El bosque de Río Manso presenta predominantemente árboles de las familias Rubiaceae, Annonaceae, Fabaceae y Myristicaceae y las especies más abundantes son Virola flexuosa A.C. Sm., Ampelocera sp. 1 y Hymatanthus sp. En El Pajuil la familias de árboles más abundantes son Rubiaceae, Arecaceae, Annonaceae y Clusiaceae y las especies con mayor número de individuos son Astrocaryum cf. alatum, Attalea butyracea y Vismia cf. baccifera (Roncancio et al., en preparación). En Río Manso hay tres especies de primates, Al. seniculus con una densidad de 2,88 ind/km2, S. leucopus con 142 ind/km2 (IC95% = 103-196) y Aotus cf. griseimembra (Roncancio et al., en preparación). En El Pajuil se encuentran cuatro especies de primates, Al. seniculus con 35 ind/km2 (IC95% = 24-52), At. hybridus con 39 ind/km2 (IC95% = 21-73), S. leucopus con 24 ind/km2 (IC95% = 15-39) y A. cf. griseimembra (Roncancio et al., 2010).
Toma de datos
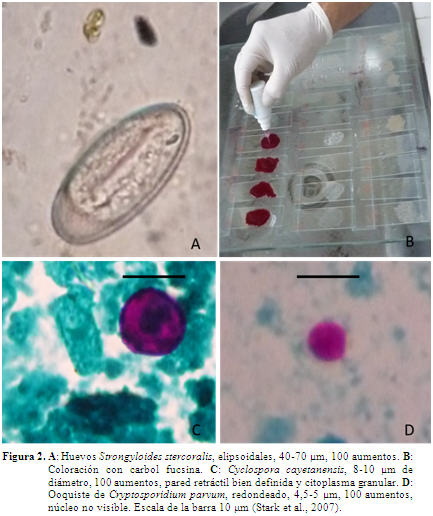
Para la colecta de muestras se siguieron los grupos de primates en cada una de las localidades hasta obtener la materia fecal en el momento de la deposición, a primeras horas del día. No se tomaron muestras que hubiesen tenido previo contacto con el suelo, para ello se emplearon áreas aisladas con senderos de fácil acceso y previamente demarcadas a la observación de los grupos. Las heces fueron conservadas en solución salina formolada al 3,5% a temperatura ambiente hasta ser entregadas al laboratorio. Para la observación de protozoos, los extendidos de materia fecal fueron fijados en metanol y coloreados con carbol fucsina (Figura 2) eliminando residuos de colorante con agua destilada y decolorando con H2S04 al 7%. Se adicionó verde malaquita por 3 minutos, nuevamente se eliminó el exceso de colorante con agua destilada. La placa se visualizó en objetivo de inmersión 100X (Casemore et al., 1985; Rigo & Franco, 2002; Montoya & Agudelo, 2005). Para la observación de nematodos se emplearon técnicas de sedimentación flotación, con solución de Sheather y observación microscópica con objetivo 10X, 40X y 100X (Lutz, 1919; Hoffmann et al., 1934; Foreyt & Foreyt, 2001).
No se emplearon técnicas de Baermann ni medios de cultivo para corroborar el diagnóstico, una vez que las muestras fueron previamente formoladas, sin embargo se recomienda para futuros análisis emplear estas técnicas que tienen mayor poder de diagnóstico en individuos inmunocomprometidos y permite mayor sensibilidad evitando falsos positivos.
Análisis de datos
Las prevalencias de los tres parásitos encontrados en las dos poblaciones de aulladores y en los monos araña se estimó con métodos bayesianos (McCarthy, 2007; Pfeiffer et al., 2008). Para Strongyloides stercoralis se construyó una distribución a priori entre 1 y 55% con base en prevalencias documentadas en primates y asumiendo que los datos observados se ajustaban a la distribución binomial. Para la estimación de la distribución posterior de la prevalencia se asumió que esta se ajustaba a la distribución uniforme (McCarthy, 2007). Para Cryptosporidium parvum y Cyclospora cayetanensis se usó una distribución a priori binomial no informativa (entre 0 y 100%) dado que para ambos agentes solo había dos datos de prevalencia, y de igual forma se estimaron las distribuciones posteriores de las prevalencias bajo distribución uniforme (McCarthy, 2007). La estimación de las prevalencias se hizo por medio de cadenas de Markov con 100.000 interacciones y teniendo en cuenta para el cálculo a partir de la 10.001. Los cálculos fueron llevados a cabo en el programa Open BUGS 3.2.2 (Lunn et al., 2000).
Resultados y Discusión
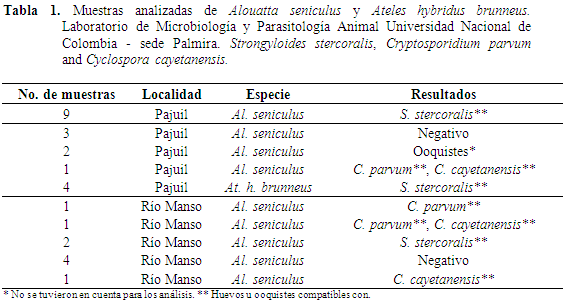
En total se colectaron 28 muestras en los dos fragmentos. En Río Manso se tomaron nueve muestras de Al. seniculus. En El Pajuil 15 muestras de Al. Seniculus y cuatro de At. hybridus. El análisis de laboratorio revela que del total de muestras 75% (21/28) fueron positivas a la presencia de formas parasitarias. En Ateles se han realizado otros trabajos en Perú y Bolivia, pero con una pequeña muestra, 8-11 individuos (Karesh et al., 1998; Phillips et al., 2004). El estudio de Carrasco et al. (2008) supera al presente con 71 muestras correspondientes a 34 individuos en Ateles belzebuth chamek.
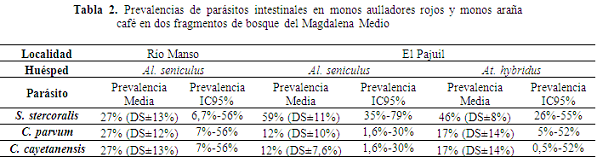
En Río Manso, en cuatro de las nueve muestras no fueron detectados parásitos y en El Pajuil tres de las 15 muestras de aullador resultaron negativas, mientras que en las cuatro muestras del Mono araña se detectó la presencia de parásitos (Tabla 1). En algunas de las muestras se presentaron formas parasitarias compatibles con ooquistes de C. parvum y C. cayetanensis (Tabla 1, Figura 2). No se descarta la presencia de otras formas de nematodos, cestodos y protozoos que se pueden llegar a encontrar con otras técnicas de diagnóstico (Martin et al., 2012). Las prevalencias encontradas para las dos especies en los dos sitios se encuentran en la Tabla 2.
En el Mono aullador rojo se encontraron en ambos sitios, tres especies de parásitos, Strongyloides stercoralis, Cryptosporidium parvum y Cyclospora cayetanensis. Para el Mono araña café, el cual solo se encontraba en El Pajuil se encontraron formas compatibles con Strongyloides stercoralis. Las formas de los huevos no son compatibles a E. vermicularis, huevos de menor tamaño 25 x 60 μm, cutícula delgada y asimétricos, aplanados por un lado y convexos por el otro ocasionalmente desarrollan larva (Caldwell, 1982). Cuando las muestras son colectadas después de varias horas y en presencia de Ancylostoma spp., generalmente huevos elipsoidales pueden llegar a embrionar y se pueden observar larvas Rhabditiformes. Probablemente, este no se presentó, una vez que las muestras (frescas) fueron conservadas y se evitó la contaminación de estas con nematodos de vida libre (Viney & Lok, 2007). De todas formas, la presencia de S. stercoralis sigue siendo subestimada bajo estos análisis y podría ser mayor al emplear migración, cultivo de larvas y al medir cargas parasitarias (Viney & Lok, 2007).
Al. seniculus ha sido evaluado en 52 ocasiones en toda su área de distribución (Brasil, amazonias peruana y boliviana, Colombia, Guayanas, Trinidad y Venezuela) y se han detectado 33 especies de parásitos, pero se estima que la riqueza de parásitos en esta especie está entre 51 y 162 especies. Por otro lado, para At. hybridus, no hay registro documentado de muestreos para detectar la presencia de parásitos. En Colombia se han documentado 77 muestreos de parásitos en primates y se han aislado 25 especies de parásitos. No obstante, se estima que pudieran haber alrededor de 36 especies de parásitos en los primates colombianos (Cooper & Nunn, 2013).
Comparando los intervalos de confianza (Cumming et al., 2007), las prevalencias para los parásitos encontrados en las dos especies de primates no resultaron significativamente diferentes entre los sitios y entre las especies. El tamaño de muestreo de esta evaluación está por debajo de las 15 muestras y por debajo de 200 muestras los análisis de prevalencia carecen de poder estadístico que permitan detectar diferencias o relaciones como, por ejemplo, atributos de los sitios (forma, tamaño, distancia de aislamiento o estructura y composición vegetal) o de la población (densidad o estructura de grupos) (O’Brien et al., 2009). No obstante, en el caso de los aulladores en donde la abundancia total está alrededor de 10 individuos en ambos sitios puede considerarse que se logró un muestreo completo, y para el Mono araña representado por un único grupo con nueve individuos se muestrearon cuatro.
Las prevalencias estimadas en este muestreo para Strongyloides stercoralis en El Pajuil para ambas especies fue del 46%, en Río manso 27% y en El Pajuil 59%. La prevalencia para ambas especies está entre las más altas documentadas hasta el momento para primates superada solo por tres estimaciones, una en Chimpancés en Uganda de 83% (Muehlenbein, 2005), una en Ghana (África) en Papio anubis en la que fue estimada un prevalencia de 53% (Ryan et al., 2012), y por una estimada para Strongyloides fulleborni del 55% en varios primates usados para consumo (Pourrut et al., 2011). Strongyloides spp. ha sido encontrado en P. anubis en Uganda con 44%, y 37,3% (Legesse & Erko, 2004; Bezjian et al., 2008), en primates cautivos en Kenia con 44,8% (Munene et al., 1998), en Chimpancés en Tanzania entre 41,2-45,5% (Bakuza & Nkwengulila, 2009) y en Aotus azarae azarae en Argentina con una prevalencia de 30% (Perea-Rodríguez et al., 2010). El resto de las prevalencias estimadas se encuentra por debajo de la estimación hecha para los aulladores del Río Manso del 26%. En México se detectó la presencia de Strongyloides spp. en Alouatta palliata mexicana con un prevalencia del 1% en bosques fragmentados y en Alouatta pigra con prevalencias del 3,5% en bosque continuos y en fragmentos (Trejo-Macías & Estrada, 2012). En Kenia, S. fuelleborni fue detectado con prevalencias del 4% para Procolobus rufomitratus y 1,8 para Cercocebus galeritus (Mbora & Munene, 2006). En Uganda, la prevalencia de S. fulleborni en Cercopithecus ascanius fue del 16% en bosques entresacados y de 4% en bosques no perturbados. Para Piliocolobus tephrosceles se estimó una prevalencia del 1% y 4% en bosques entresacados y no perturbados respectivamente igual que para Colobus guereza en donde las prevalencias fueron del 4% para entresacados y 3% para no perturbados (Gillespie et al., 2005a), en Gorilas se encontró una prevalencia de 1,4% (Sleeman et al., 2000) y del 10% en Alouatta caraya en Argentina (Milozzi et al., 2012).
El encuentro de larvas rabditiformes de S. stercoralis mediante técnicas de Baermann nos hubiera permitido corroborar el diagnóstico morfológico una vez que estas fueron preservadas en formol, de aquí la dificultad de hacer cultivos de tercer estadio larval (L3) en laboratorio. Los huevos de S. stercoralis son larvados, típicos de la Superfamilia: Rhabditoidea (Andrássy, 1983). Este nematodo afecta a millones de personas en el mundo entero y en regiones tropicales se considera endémico (Nilforoushan et al., 2007). La presencia de Strongyloides spp. está asociada con el encuentro de parásitos como Acanthocephalos y Microsporidios, y su identificación en las pruebas coprológicas de rutina se basa en la observación de los huevos elipsoidales y con el estado embrional en su estado morular que miden entre 50-58 μm por 30-34 μm, la larva L1 y L2 mide 350 μm de largo y 15μm de diámetro (Viney & Lok, 2007; Chinchilla et al., 2010).
Futuros trabajos de genotipificación son necesarios mediante secuencias de aminoácidos específicas (ITS1), Forward (5’-attgatagctctttcatgatttag-3’), Reverse (5’-AACAGGAACATAATGATCACTAC-3’) para la identificación del género Strongyloides y la amplificación de espacios de transcripción interna (ITS1) para la especie (Labes et al., 2011) tanto en muestras directas de materia fecal, técnicas de flotación y sedimentos de Baermann; adicionalmente, es importante conservar una muestra en formol al 10% para la identificación de huevos y para la determinación de cargas parasitarias y otra para el cultivo de huevos, producción de estados larvales y su posterior identificación. Esto permitiría diferenciar nuevas especies aún no reportadas para el país asociadas a Al. seniculus y At. hybridus. Queremos aclarar que los resultados negativos no necesariamente indican la ausencia de la infección, pero su presencia o encuentro a través de técnicas coprológicas tradicionales indican que puede existir una asociación heterotípica negativa. En general, las parasitosis con cargas patogénicas elevadas llevan a una disminución en la capacidad de respuesta del sistema inmunológico para prevenir o controlar los estados de infección; sin embargo, es necesario hacer mayor número de evaluaciones para mejorar el diagnóstico, cuantificar la presencia, establecer mejor los parámetros en el tiempo y asociar otros factores de riesgo en la compleja asociación agente-hospedero-medio ambiente.
Para ambos sitios fue confirmada la presencia de C. parvum. Este protozoario ha sido encontrado en otros mamíferos silvestres (Appelbee et al., 2005) y particularmente para los primates en gorilas (Gorilla gorilla beringei) en Uganda (Nunn et al., 2011), en P. anubis y C. aethiops con prevalencias de 11,9% y 29,3% respectivamente (Legesse & Erko, 2004) y chimpancés 21,7% (Mbaya & Udenye, 2011). Por el contrario, en 90 muestras de Al. caraya en Argentina la presencia de Cryptosporidium spp. no fue detectado a pesar de haberse detectado en la población humana local, sugiriendo que no es un componente natural de los parásitos en aulladores y no se transmite desde la población humana (Kowalewski et al., 2011). Para At. hybridus, a pesar de no haberse confirmado la presencie de C. parvum, pero sabiendo que el microorganismo se encuentra en el sitio, el uso de técnicas bayesianas permitió estimar una prevalencia alrededor del 17%. No obstante, características de la especie pueden brindarle menor vulnerabilidad que los aulladores a infestaciones con este protozoario, pero en un escenario conservador, la probabilidad de contaminación debe ser considerada (reduce la probabilidad de cometer error tipo II con relación a la hipótesis de que el protozoario se encuentre en los monos araña en este sitio).
En el caso de C. cayetanensis, igualmente se encontró en ambos sitios para aulladores y en el caso del Mono araña se aplicó el mismo principio de precaución para la estimación de sus prevalencia. Para este protozoario se han estimado prevalencias en P. anubis de 13,3% y en C. aethiops de 22% en Etiopía (Legesse & Erko, 2004).
Los parásitos gastrointestinales, pueden afectar directamente la sobrevivencia y reproducción del hospedero a través de efectos patológicos y reducir su condición (Hudson et al., 1992; Coop & Holmes, 1996). Severas parasitosis de organismos gastrointestinales pueden generar pérdida de sangre, daño tisular, aborto espontáneo, malformaciones congénitas y muerte (Katz et al., 2012). Infecciones menores, las cuales son más comunes, pueden alterar la absorción de nutrientes, incrementar la demanda de energía y perjudicar el desplazamiento, alimentación, evasión de depredadores y la competencia por recursos y parejas (Hudson et al., 1992; Coop & Holmes, 1996).
S. stercoralis, probablemente hacía parte del proceso natural de regulación de las poblaciones, por lo tanto, puede considerarse potencialmente peligroso dadas las altas prevalencias encontradas causadas probablemente por incremento de la susceptibilidad del huésped al ser una población pequeña y aislada (Chapman et al., 2005; Gillespie et al., 2005a, 2005b; Gillespie & Chapman, 2006).
Cyclospora cayetanensis es un protozoo coccidio que pertenece al phylum Apicomplexa, suborden Eimeriida, patógeno animal, pero reconocido en humanos en las últimas dos décadas. Las formas parasitarias se caracterizan por ser esféricas, acidófilas, de 8 a 10 µm de diámetro, se diferencia del ooquiste de Cryptosporium spp., el cual es muy similar de forma, acidófilo, pero de 4 a 6 µm de diámetro (Figura 2) (Stark et al., 2007; Weitz et al., 2009).
Sistemas inmunes debilitados podría explicar la presencia de C. parvum y C. cayetanensis (Medina-Vogel, 2010). Los aulladores pueden ser una especie particularmente vulnerable a las infestaciones parasitarias por ser una especie que hace uso con mayor intensidad de su territorio y está sometida a mayores niveles de estrés por protegerlo (Nunn et al., 2011). En primates la tasa de emergencia de enfermedades se debe principalmente a cambios ambientales, el uso de la tierra, la dinámica poblacional humana, el comportamiento frente a los ecosistemas, uso de los recursos hídricos y a los cambios en tecnología e industria (Lederberg & Shope, 1992). Los primates se encuentran en una de las regiones del país que más se ha visto sometida dramáticos cambios (IDEAM, 2010). Por lo tanto, la presencia de S. stercoralis sugiere un potencial riesgo en salud pública una vez que este parasito afecta 30 millones de personas en 70 países (Siddiqui & Berk, 2001), sin embargo la identificación molecular y la documentación de su presencia en poblaciones locales humanas es necesaria para confirmar la transmisión zoonótica (Ryan et al., 2012). S. stercoralis desarrolla ciclos de vida libres en el suelo y reside en el intestino de humanos y otros primates depositando huevos en la mucosa intestinal. Los adultos no pasan más allá de la muscular de la mucosa, pero las larvas rabditiformes tienen la capacidad de migrar a otros tejidos y diferentes órganos. Las larvas filariformes en el suelo pueden penetrar la piel, por circulación y microcirculación llegan a los tejidos pulmonares donde mecánicamente pasan el espacio alveolar, ascienden el árbol traqueo bronquial y a través de la glotis son ingeridos retornando al intestino y repitiendo su ciclo endógeno (Berk et al., 1987).
La transmisión de agentes infecciosos desde animales silvestres, es una respuesta de adaptación de estos, como consecuencia a la reducción de sus hospederos y ambientes naturales obligando a una nueva adaptación en humanos y animales domésticos. Estas nuevas adaptaciones se pueden evitar manteniendo la integridad ecológica de los ecosistemas, evitando y tomando adecuadas precauciones al contacto (Jones et al., 2008). La fragmentación del bosque obliga a los primates a descender al suelo y aumenta la probabilidad de contacto con animales domésticos o humanos como también la propagación de estos en grupos aislados (Valdespino et al., 2010).
La presencia de C. cayatenensis, S. stercoralis y C. parvum indica un potencial riesgo para la salud pública ya que son consideradas zoonosis. Existen 14 especies de Cryptosporidium spp. Hasta ahora aceptadas con gran diversidad genética infectando mamíferos, reptiles y aves. Entre las poblaciones asociadas a rumiantes está C. parvum (Alves et al., 2005). Cryptosporidium spp. ha sido diagnosticado en primates de zoológico asociado a la presencia de Balantidium coli y Blastocystis spp. y con mayores prevalencias si se compara con helmintos diagnosticados como Toxocara cati, Spirometra spp., Ascaris spp. (Lim et al., 2008).
Los monos aulladores se han considerado buenas especies centinelas por su alto grado de plasticidad fenotípica y por su probable mayor tolerancia a ciertos tipos de presión antrópica para evaluar la dinámica y transmisión entre primates silvestres humanos y animales domésticos de algunas enfermedades (Kowalewski et al., 2011). El hecho de poseer un sistema social estructurado, permite que la información sobre las características de parásitos que infectan animales silvestres, como latencia, transmisibilidad y tasas de mortalidad relacionadas, pueda ser estimada más efectivamente (Nunn et al., 2011). No obstante, la riqueza de parásitos en poblaciones animales puede estar asociada con un rango de factores que pueden operar a múltiples escalas, en este sentido estas evaluaciones deben basarse en estudios longitudinales de animales conocidos y en contextos ecológicos bien documentados, y bajo diseños que puedan diferenciar la importancia de los diferentes factores que afectan la riqueza de parásitos en los hospederos y del impacto en las poblaciones silvestres (Benavides et al., 2012).
El Mono aullador, muchas veces actúa como portador sano asintomático de parásitos gastrointestinales (áreas endémicas). Factores de estrés, disminuyen la capacidad de soportar cargas parasitarias elevadas y aparece la manifestación clínica, en muchos casos con alta mortalidad (Mbaya & Udenye, 2011). Procesos de súper-infección (autoinfección) por Strongyloidiasis pueden desencadenar dolor abdominal, diarrea, larva migrans con urticaria en perineo, abdomen y espacios interdigitales; asma, bronquitis, neumonía e insuficiencia respiratoria también son frecuentes (Liu & Weller, 1993; Grove, 1996).
Conclusiones
S. stercoralis es uno de los parásitos con mayor prevalencia en El Pajuil para las dos poblaciones Atelidae (Al. senniculus y At. hybridus). Aunque la prevalencia de C. cayatanensis y C. parvum fue menor, su presencia indica que existe contaminación de alimentos, aguas y suelos en las dos áreas de estudio. Finalmente, la prevalencia de estos parásitos en Atelidae puede ser un indicador del efecto de la reducción y fragmentación de los hábitats.
Agradecimientos
Al programa Colombia de la Wildlife Conservation Society por su apoyo económico y técnico, a Amilvia Acosta, Lina García y Fernando Ramos Naranjo por su colaboración en la colecta y análisis de muestras. Agradecimiento al comité editorial de la Revista.
Referencias Bibliográficas
· Aguirre, A.A.; Ostfeld, R.S.; Tabor, G.M. et al. Conservation medicine: ecological health in practice. USA: Oxford University Press, 2002. 407p. · Aldana, A.M.; Beltrán, M.; Torres-Neira, J. et al. Habitat characterization and population density of Brown Spider Monkeys (Ateles hybridus) in Magdalena Valley, Colombia. Neotropical Primates, v.15, n.2, p.46-50, 2008. · Alves, M.; Xiao, L.; Lemos, V. et al. Occurrence a molecular characterization of Cryptosporidium spp. in mammals and reptiles at the Lisbon Zoo. Parasitol Research, v.97, n.2, p.108-112, 2005. · Andrássy, l. A Taxonomic review of the Suborder Rhabditina (Nematoda: Secernentia). Paris: Orstom, 1983. 241p. · Appelbee, A.J.; Thompson, R.C.A.; Olson, M.E. Giardia and Cryptosporidium in mammalian wildlife-current status and future needs. Trends Parasitology, v.21, p.370-376, 2005. · Bakuza, J.S.; Nkwengulila, G. Variation over time in parasite prevalence among free-ranging chimpanzees at Gombe National Park, Tanzania. International Journal of Primatology, v.30, p.43-53, 2009. · Begon, M.; Townsend, C.R.; Harper, J.L. Ecology: From Individuals to Ecosystems. Oxford, UK: John Wiley & Sons, 2009. 752p. · Beldoménico, P.M. Serie: Medicina Veterinaria y Fauna, 4. Salud y conservación de biodiversidad. Santa Fe, Argentina: Facultad de Ciencias Veterinarias - Universidad Nacional del Litoral, CONICET, 2013. p.14. · Benavides, J.A.; Huchard, E.; Pettorelli, N. et al. From parasite encounter to infection: multiple-scale drivers of parasite richness in a wild social primate population. American Journal of Physical Anthropology, v.147, p.52-63, 2012. · Berk, S.L.; Verghese, A.; Alvarez, S.; Hall, K.; Smith, B. Clinical and epidemiologic features of strongyloidiasis. A prospective study in rural Tennessee. Archives of Internal Medicine, v. 147, p.1257-1261, 1987. · Bezjian, M.; Gillespie, T.R.; Chapman, C.A. et al. Coprologic evidence of gastrointestinal helminths of forest baboons, Papioanubis, in Kibale National Park, Uganda. Journal of Wild Diseases, v.44, p.878-887, 2008. · Caldwell, J.P. Pinworms (Enterobius vermicularis). Canadian Family Physician, v.28, p.306-309, 1982. · Carrasco, F.; Tantaleán, M.; Gibson, K.N. et al. Prevalencia de helmintos intestinales de una población de monos maquisapas silvestres Ateles belzebuth chamek en el Parque Nacional de Manu, Perú. Neotropical Helminthology, v.2, n.1, p.19-26, 2008. · Casemore, D.P.; Armstrong, M.; Sands, R.L. Laboratory diagnosis of cryptosporidiosis. Journal of Clinic and Pathology, v.38, p.1337-1341, 1985. · Chapman, C.A.; Gillespie, T.R.; Goldberg, T.L. Primates and the ecology of their infectious diseases: how will anthropogenic change affect host-parasite interactions? Evolutionary Anthropology: Issues, News, and Reviews, v.14, p.134-144, 2005. · Chinchilla, M.; Urbani, B.; Valerio, I. et al. Intestinal parasites in white-faced capuchin monkeys Cebus capucinus (Primates: Cebidae) inhabiting a protected area in the Limón province of Northeastern Costa Rica. Revista de Biología Tropical, v.58, p.1335-1346, 2010. · Clayton, D.H.; Moore, J. Host-parasite evolution: general principles and avian models. Oxford, UK: Oxford University Press, 1997. 473p. · Coop, R.L.; Holmes, P.H. Nutrition and parasite interaction. International Journal for Parasitology, v.26, p.951-962, 1996. · Cooper, N.; Nunn, C.L. Identifying future zoonotic disease threats: Where are the gaps in our understanding of primate infectious diseases? Executive Master of Public Health, v.1, p.27-36, 2013. · Cumming, G.; Fidler, F.; Vaux, D.L. Error bars in experimental biology. The Journal of Cell Biology, v.177, p.7-11, 2007. · De la Torre, S.; Morales, A.L.; Link, A. et al. 2008. Cebus albifrons ssp. versicolor. In: IUCN 2013. IUCN Red List of Threatened Species. Version 2013.1. www.iucnredlist.org, 2008. · Delahay, R.J.; Smith, G.C.; Hutchings, M.R. Management of disease in wild mammals. Edinburgh, UK: Springer, 2009. 284p. · Foreyt, W.J.; Foreyt, B. Veterinary parasitology reference manual. 5th Edition. Ames, Iowa: Iowa State University Press, 2001. 235p. · Gillespie, T.R.; Chapman, C.A. Predicción de la dinámica de la infección parasitaria en metapoblaciones de primates con base en atributos de la fragmentación de bosques. Conservation Biology, v.20, p.441-448, 2006. · Gillespie, T.R.; Chapman, C.A.; Greiner, E.C. Effects of logging on gastrointestinal parasite infections and infection risk in African primates. Journal of Applied Ecology, v.42, p.699-707, 2005a. · Gillespie, T.R.; Greiner, E.C.; Chapman, C.A. Gastrointestinal parasites of the colobus monkeys of Uganda. Journal of Parasitology, v.91, p.569-573, 2005b. · Grove, D.I. Human strongyloidiasis. Advances in Parasitology, v.38, p.251-309, 1996. · Hijmans, R.J.; Cameron, S.E.; Parra, J.L. et al. Very high resolution interpolated climate surfaces for global land areas. International Journal of Climatology, v.25, p.1965-1978, 2005. · Hoffmann, W.A.; Pons, J.A.; Janer, J.L. The sedimentation concentration method in Schistosomiasis mansoni. Puerto Rico Journal of Public Health Tropical Medicine, v.9, p.283-91, 1934. · Hudson, P.J.; Newborn, D.; Dobson, A.P. Regulation and stability of a free-living host-parasite system: Trichostrongylus tenuis in red grouse. I. Monitoring and Parasite Reduction Experiments. The Journal of Animal Ecology, v.61, p.477-486, 1992. · IDEAM. Leyenda nacional de coberturas de la tierra. Metodología CORINE Land Cover adaptada para Colombia Escala 1:100.000. Bogotá, D.C.: Instituto de Hidrología, Meteorología y Estudios Ambientales, 2010. 72p. · IUCN. IUCN Red list of threatened species. Versión 2013.1. 2013. Disponible en: www.iucnredlist.org Accesado en 6/7/2013. · Jones, K.E.; Patel, N.G.; Levy, M.A. et al. Global trends in emerging infectious diseases. Nature, v.451, p.990-993, 2008. · Karesh, W.B.; Wallace, R.B.; Painter, R.L.E.; Rumiz, D.; Braselton, W.E.; Dierenfeld, E.S.; Puche, H. Immobilization and health assessment of free-ranging black spider monkeys (Ateles paniscus chamek). American Journal of Primatology, v.44, p.107-123, 1998. · Katz, M.; Despommier, D.D.; Gwadz, R.W. Parasitic diseases. Nueva York, USA: Springer, 2012. 313p. · Kowalewski, M.M.; Salzer, J.S.; Deutsch, J.C. et al. Black and gold howler monkeys (Alouatta caraya) as sentinels of ecosystem health: patterns of zoonotic protozoa infection relative to degree of human-primate contact. American Journal of Primatology, v.73, p.75-83, 2011. · Labes, E.M.; Wijayanti, N.; Deplazes, P. et al. Genetic characterization of Strongyloides spp. from captive, semi-captive and wild Bornean orangutans (Pongo pygmaeus) in Central and East Kalimantan, Borneo, Indonesia. Parasitology, v.138, p.1417-1422, 2011. · Lederberg, J.; Shope, R. Emerging infections: microbial threats to health in the United States. Washington, D.C., USA: National Academy Press, 1992. 294p. · Legesse, M.; Erko, B. Zoonotic intestinal parasites in Papio anubis (baboon) and Cercopithecus aethiops (vervet) from four localities in Ethiopia. Acta Tropica, v.90, p.231-236, 2004. · Leroy, E.M.; Rouquet, P.; Formenty, P. et al. Multiple Ebola virus transmission events and rapid decline of central African wildlife. Science, v.303, p.387-390, 2004. · Lim, Y.A.L.; Ngui, R.; Shukri, J. et al. Intestinal parasites in various animals at a zoo in Malaysia. Veterinary Parasitology, v.157, p.154-159, 2008. · Liu, L.X.; Weller, P.F. Strongyloidiasis and other intestinal nematode infections. Infectious Disease Clinics of North America, v.7, p.655-682, 1993. · Lunn, D.; Thomas, A.; Best, N. et al. A Bayesian modeling framework: concepts, structure, and extensibility. Statistic and Computing, v.10, p.325-337, 2000. · Lutz, A. O. Schistosomum mansoni e a Schistosomatose segundo observações, feitas no Brazil. Mem. Inst. Oswaldo Cruz, v.11, p.121-150, 1919. · Maizels, R.M.; Bundy, D.A.; Selkirk, M.E.; et al. Immunological modulation and evasion by helminth parasites in human populations. Nature, v.365, p.797-805, 1993. · Martin, S.; Carrillo-Bilbao, G.A.; Celi, M. et al. Parásitos en primates de la Amazonía Ecuatoriana: una herramienta para la salud pública y la conservación. In: II National Meeting of Infectious Disease Research and Tropical Medicine, Quito, Ecuador. Conferencia no publicada. Pontificia Universidad Católica de Ecuador, 2012. · Mbaya, A.W.; Udenye, U.J. Gastrointestinal parasites of captive and free-roaming primates at the Afi Mountain Primate Conservation Area in Calabar, Nigeria and their zoonotic implications. Pakistan Journal of Biological Sciences, v.14, p.709-714, 2011. · Mbora, D.N.; Munene, E. Gastrointestinal parasites of critically endangered primates endemic to Tana River, Kenya: Tana River red colobus (Procolobus rufomitratus) and crested mangabey (Cercocebus galeritus). Journal of Parasitology, v.92, p.928-932, 2006. · McCallum, H. Population parameters: estimation for ecological models. Brisbane, Australia: Wiley-Blackwell, 2000. 348p. · McCarthy, M.A. Bayesian methods for ecology. Cambridge, UK: Cambridge University Press, 2007. 306p. · Medina-Vogel, G. Ecology of emerging infectious diseases and wild species conservation. Archivos de Medicina Veterinaria, v.42, p.11-24, 2010. · Milozzi, C.; Bruno, G.; Cundom, E. et al. Parásitos intestinales de Alouatta caraya (Primates, Ceboidea): estudio preliminar en semi cautiverio y en vida silvestre en la Argentina. Mastozoología Neotropical, v.19, p.163-178, 2012. · Montoya, M.; Agudelo, S. Parásitos intestinales oportunistas. Teoría y práctica. Medellín: Biogénesis Fondo Editorial, 2005. p.31-35. · Morales-Jiménez, A.L.; Link, A.; Stevenson, P. Saguinus leucopus. In: IUCN 2013. IUCN Red list of threatened species, 2008. Disponible en: www.iucnredlist.org Accesado en: 05/13/2013. · Morner, T.; Obendorf, D.L.; Artois, M. Surveillance and monitoring of wildlife diseases. Revue Scientifique et Technique-Office International Des Epizooties, v.21, p.67-76, 2002. · Muehlenbein, M.P. Parasitological analyses of the male chimpanzees (Pan troglodytes schweinfurthii) at Ngogo, Kibale National Park, Uganda. American Journal of Primatology, v.65, p.167-179, 2005. · Munene, E.; Otsyula, M.; Mbaabu, D.A. et al. Helminth and protozoan gastrointestinal tract parasites in captive and wild-trapped African non-human primates. Veterinary Parasitology, v.78, p.195-201, 1998. · Nilforoushan, M.R.; Mirhendi, H.; Rezaie, S. et al. A DNA-Based Identification of Strongyloides stercoralis Isolates from Iran. Iranian Journal of Public Health, v.36, p.16-20, 2007. · Nunn, C.; Altizer, S. Infectious diseases in primates: behavior, ecology and evolution. Nueva York, USA: Oxford University Press, 2006. 85p. · Nunn, C.L.; Thrall, P.H.; Leendertz, F.H. et al. The spread of fecally transmitted parasites in socially-structured populations. PLoS ONE, v.6, n.6, e21677, 2011. · O’Brien, C.; Van Riper, C.; Myers, D.E. Making reliable decisions in the study of wildlife diseases: using hypothesis tests, statistical power, and observed effects. Journal of Wildlife Diseases, v.45, p.700-712, 2009. · Perea-Rodríguez, J.P.; Milano, A.M.; Osherov, B.E. et al. Gastrointestinal parasites of owl monkeys (Aotus azarai azarai) in the Argentinean Chaco. Neotropical Primates, v.17, p.7-11, 2010. · Pfeiffer, D.; Robinson, T.; Stevenson, M. et al. Spatial analysis in epidemiology. Nueva York, USA: Oxford University Press New York. 2008. 208p. · Phillips, K.A.; Hass, M.E.; Grafton, B.W.; Yrivarren, M. Survey of the gastrointestinal parasites of the primate community at Tambopata National Reserve, Peru. Journal of Zoology London, v.264, p.149-151, 2004. · Pourrut, X.; Diffo, J.L.D.; Somo, R.M. et al. Prevalence of gastrointestinal parasites in primate bushmeat and pets in Cameroon. Veterinary Parasitology, v.175, p.187-191, 2011. · Rigo, C.R.; Franco, R.M.B. Comparison between the modified Ziehl-Neelsen and Acid-Fast-Trichrome methods for fecal screening of Cryptosporidium parvum and Isospora belli. Journal of the Brazilian Society of Tropical Medicine, v.35, n.3, p.209-213, 2002. · Roncancio, N.; Gómez, K.; Quintero, F. Comparisons of population density and group structure for the Variegated-spider monkey(Ateles hybridus), Serrania de San Lucas (Bolívar-Colombia).In: Defler, T.R.; Stevenson, P.R.; Bueno, M.L.; Guzmán, D.C. (Ed). Primates Colombianos En Peligro de Extinción. Bogotá, Asociación Primatológica Colombiana, 2013. p. 235-248. · Roncancio, N.J.; García, L.M.; Acosta, A. Densidad poblacional y estructura de grupo de Ateles hybridus brunneus (Primates: Atelidae) en un fragmento de bosque aislado en el suroriente de Antioquia, Colombia. Mastozoología Neotropical, v.17, p.385-389, 2010. · Roncancio, N.J.; Rojas, W.; Defler, T. Densidad poblacional de Saguinus leucopus en remanentes de bosque con diferentes características físicas y biológicas. Mastozoología Neotropical, v.18, p.105-117, 2011. · Roncancio, N.; Rojas, W.; Estévez-Varón, J. Densidad Poblacional y tamaño de grupo de Saguinus leucopus en parches de bosque en el departamento de Caldas, Colombia. Neotropical Primates, v.15, p.63-67, 2008. · Roncancio-Duque, N.; Acosta, A.; García, L.; et al. Distribución potencial y disponibilidad de hábitat actual del primate endémico de Colombia y en peligro de extinción Titi Gris (Saguinus leucopus). In: Defler, T.R.; Stevenson, P.R.; Bueno, M.L.; Guzmán, D.C. (Ed). Primates Colombianos En Peligro de Extinción. Bogotá, Asociación Primatológica Colombiana, 2013. p. 217-234. · Ryan, S.J.; Brashares, J.S.; Walsh, C. et al. A Survey of gastrointestinal parasites of olive baboons (Papio anubis) in human settlement areas of Mole National Park, Ghana. Journal of Parasitology, v.98, p.885-888, 2012. · Sharp, P.M.; Hahn, B.H. Origins of HIV and the AIDS Pandemic. Cold Spring Harbor Perspectives in Medicine, v.1, 2011. · Siddiqui, A.A.; Berk, S.L. Diagnosis of Strongyloides stercoralis infection. Travel Medicine, v.33, p.1041, 2001. · Sleeman, J.M.; Meader, L.L.; Mudakikwa, A.B. et al. Gastrointestinal parasites of mountain gorillas (Gorilla gorilla beringei) in the parc national des volcans, Rwanda. Journal of Zoo and Wildlife Medicine, v.31, p.322-328, 2000. · Stark, D.; Van Hal, S.; Marriott, D.; Ellis, J.; Harkness, J. Irritable bowel syndrome: A review on the role of intestinal protozoa and the importance of their detection and diagnosis. Internal Journal for Parasitology, v.37, n.1, p.11-20, 2007. · · Trejo-Macías, G.; Estrada, A. Risk factors connected to gastrointestinal parasites in mantled. Acta Zoológica Sínica, v.58, n.8, p.375-383, 2012. · Urbani, B.; Morales, A. L.; Link, A. et al. Ateles hybridus. In: IUCN, 2013. IUCN Red list of threatened species. Version 2013.1. 2008. Disponible en: www.iucnredlist.org Accesado en: 13/08/2013. · Valdespino, C.; Rico-Hernández, G.; Mandujano, S. Gastrointestinal parasites of Howler monkeys (Alouatta palliata) inhabiting the fragmented landscape of the Santa Marta mountain range, Veracruz, Mexico. American Journal of Primatology, v.72, n.6, p.539-548, 2010. · Viney, M.E.; Lok, J.B. Strongyloides spp. WormBook, may 23, 2007. doi/10.1895/wormbook.1.141.1, · Weitz, J.C.; Weitz, C.R.; Canales, M.R. et al. Cyclospora cayetanensis infection: updated review a propos of three cases of traveler’s diarrhea. Revista Chilena Infectología, v.26, n.6, p. 549-54, 2009.
Roncancio-Duque, N.; Benavides Montaño, J.A. Parásitos intestinales en poblaciones pequeñas y aisladas de Mono aullador rojo (Alouatta seniculus) y Mono araña café (Ateleshybridus), Atelidae – Primates en el Magdalena Medio, Colombia. Veterinaria y Zootecnia, v.7, n.1, p.x-x, 2013. <http://200.21.104.25/vetzootec/index.php?option=com_content&view=article&id=132> |