|
Desarrollo de una prueba de Western Blot para la detección de Brucella canis en perros1
ARTÍCULO DE
(Recibido: Abril 2 de 2014 Aprobado: Junio 20 de 2014 Actualizado: 19 Noviembre de 2014)
RESUMEN: La brucelosis canina es una enfermedad zoonótica causada por Brucella canis que afecta el sistema reproductivo de los caninos. La infección se disemina rápidamente en criaderos, por la presencia de individuos asintomáticos. Los métodos diagnóstico más utilizados son el hemocultivo y la prueba serológica 2ME-PARP, sin embargo presentan problemas de sensibilidad y especificidad por lo cual una prueba de Western Blot podría servir como complemento para obtener un diagnóstico certero de esta infección. El objetivo de este trabajo fue desarrollar una prueba de Western Blot para la detección de B. canis en perros. Se usaron proteínas de dos cepas de B. canis: M- y Brucella canis cepa Oliveri. Se utilizaron sueros de caninos de criaderos del Área Metropolitana del Valle de Aburrá, de la seroteca del grupo Biogénesis-Vericel, los cuales se clasificaron en 4 grupos según los resultados de las pruebas 2ME-PARP y hemocultivo. Se realizó SDS-Page al 12% y Western Blot, utilizando como anticuerpo primario una mezcla de 4 sueros de cada grupo a una dilución de 1:500 y como anticuerpo secundario anti IgG canino conjugado con peroxidasa dilución 1:6000. Posteriormente se analizó el peso de las bandas y se estableció un perfil de bandas inmunorreactivas para cada grupo. Se observaron diferencias en las bandas inmunorreactivas de acuerdo al grupo analizado. En el grupo 2 (2ME-PARP y hemocultivo positivos) se observaron bandas inmunorreactivas de aproximadamente 70, 55, 48 y 40 kDa. En el grupo 3 (2ME-PARP positivo, hemocultivo negativo) bandas de aproximadamente 55 y 40 kDa. En el grupo 4 (2ME-PARP negativo y hemocultivo positivo) bandas de 20, 18 y 12 kDa. Esta prueba de Western Blot, permite diferenciar caninos infectados de no infectados por los perfiles de bandas encontrados para cada grupo.
Palabras clave: Inmunorreactividad, anticuerpos, diagnóstico, caninos
Development of a Western Blot test for detection of Brucella canis in dogs
ABSTRACT: Canine Brucellosis is a zoonotic disease caused by Brucella canis that affects canines’ reproductive system . The infection spreads rapidly in breeding kennels because of the presence of asymptomatic individuals. The most commonly used diagnostic methods are the blood culture and the 2ME-RSAT serological test. However, they show problems of sensitivity and specificity, so a Western Blot test could serve as a complement to obtain an accurate diagnosis of this infection. The aim of this work was to develop a Western Blot test for the detection of B. canis in dogs. Proteins of two strains of B. canis were used; M- and Brucella canis Oliveri strain. Sera from kennel dogs from the metropolitan area of the Aburrá Valley from the serum bank of the Biogenesis research group which were classified into 4 groups according to the 2ME-RSAT tests results and blood culture were used. SDS-Page was carried out at 12% and Western blot, using as primary antibody a mixture of 4 sera from each group at a 1:500 dilution, and as secondary antibody anti canine IgG peroxidase conjugate 1:6000 dilution, was used. Then the weight of the bands was analyzed and an immunoreactive band for each group was established. Differences in the immunoreactive bands for each analyzed group were observed. In group 2 (2ME-RSAT and positive blood culture) immunoreactive bands of approximately 70, 55, 48 and 40 kDa were observed. In group 3 (2ME-RSAT positive, blood culture negative) bands of approximately 55 and 40 kDa were observed. In group 4 (2ME-RSAT negative and blood culture positive) bands of 20, 18 and 12 kDa were observed. This Western Blot test allows to differentiate infected from uninfected dogs because of the ban profile for each group.
Key words: Inmunoreactivity, antibodies, diagnosis, canines
Introducción
La brucelosis canina es una enfermedad zoonótica causada por la bacteria Brucella canis, que es un cocobacilo Gram negativo (Carmichael, 1966) de gran capacidad infectiva, que se ubica en los sistemas reproductivos de los perros sexualmente maduros, provocando en hembras placentitis seguido de aborto (generalmente en el último tercio de la gestación); induce atrofia testicular, epididimitis y orquitis en machos (Carmichael, 1996) y puede provocar esterilidad en ambos sexos (Rovid et al., 2010). La infección en un criadero se introduce por el contacto con animales infectados, dado que esta bacteria se encuentra en los fluidos vaginales de las perras, también se localiza en los tejidos y fluidos asociados al embarazo, leche (Olivera et al., 2011), semen, por la contaminación de la piel erosionada y las superficies de las mucosas de los perros (Rovid et al., 2010); los animales al estar confinados son más susceptibles a contraer la bacteria, provocando así una rápida propagación (Rovid et al., 2010).
También se pueden presentar casos de caninos portadores, pero que no presentan síntomas, siendo estos especímenes los más peligrosos ya que pueden expandir la enfermedad en el entorno en el que se localizan (Lucero et al., 2005).
B. canis se puede transmitir también a los humanos a través del contacto directo con secreciones de animales infectados (Olivera & Di-Lorenzo, 2009) y accidentes de laboratorio (Lucero et al., 2010); debido a las manifestaciones variables que presenta la enfermedad y a la falta de signos físicos, se dificulta el diagnóstico en humanos (Jacob et al., 2008); es una enfermedad multisistémica, siendo el sistema óseo el más frecuentemente afectado (Lucero et al., 2007).
Los métodos más usados para el diagnóstico de B. canis en caninos son la prueba de aglutinación rápida en placa con 2-mercaptoetanol (2ME-PARP), que es una prueba serológica tamiz (Carmichael, 1987) y el hemocultivo que es la prueba de oro. Otras pruebas serológicas como las pruebas de ELISA y Western Blot, se han desarrollado en algunos países como Argentina (Lucero et al., 2002) y Brasil (Daltro de Oliveira et al., 2011) pero sus resultados no se han extrapolado a otros países.
El diagnóstico de esta infección es difícil debido a que las pruebas serológicas utilizadas pueden presentar resultados variables en cuanto a su sensibilidad y especificidad dependiendo del estadio de la infección del perro, ya que en los casos agudos aún con hemocultivo positivo, puede no detectarse la presencia de anticuerpos. En los casos crónicos, la prueba serológica puede ser positiva con hemocultivos negativos, pues la bacteria no está en circulación sino focalizada en algún órgano del sistema linfoide (Wanke, 2004). El diagnóstico depende entonces de la confirmación de la presencia de la infección de la bacteria, ya sea por aislamiento bacteriológico (MacPhee, 2010), detección de anticuerpos o de material genético bacteriano en sangre o en otros fluidos como leche (Olivera et al., 2011) por técnicas moleculares como la reacción en cadena de la polimerasa (PCR).
El problema principal del diagnóstico serológico, es que se pueden presentar resultados variables en estas pruebas, ya que un canino puede ser seronegativo incluso con hemocultivo positivo o pueden ser serológicamente positivos con hemocultivo negativo (Castrillón-Salazar et al., 2013). Estas diferencias en el resultado de la prueba 2ME-PARP, generan dudas sobre los resultados, ya que no siempre se puede realizar confirmación de la infección con hemocultivo, por lo cual se sugiere repetir las pruebas serológicas cada determinado tiempo para llegar a una conclusión definitiva sobre el diagnóstico del canino. Una alternativa a este problema sería contar con otra prueba serológica más específica como el Western Blot, ya que la unión antígeno-anticuerpo permite detectar proteínas inmunorreactivas específicas, por lo cual sería una herramienta adicional para la toma de decisiones en cuanto al diagnóstico de esta infección.
Por lo anterior, el objetivo del presente trabajo fue desarrollar una prueba de Western Blot utilizando la cepa B. canis M- (Carmichael, 1996) y una cepa de campo aislada y secuenciada completamente: B. canis str. Oliveri (número de acceso HG803175.1 y HG803176.1). Para determinar la sensibilidad y especificidad de la técnica se comparó la especificidad del extracto proteico total de B. canis de cada una de las dos cepas mencionadas frente a varios grupos de sueros de caninos con diferentes características.
Materiales y Métodos
Extracción de proteínas: Se probaron cinco métodos de extracción de proteínas y se cuantificaron para determinar cuál fue el mejor. Los cinco métodos se describen brevemente a continuación:
Protocolo 1 (Daltro de Oliveira et al., 2011): Se realizaron cultivos de cada una de las dos cepas de B. canis en TSA (tripticasa soya agar) a partir de leche descremada, los agares se incubaron a 37°C por 48 h.
Posteriormente, se sembraron los cultivos en tubos de 5 ml de TSC (tripticasa soya caldo) y se incubaron a 37°C por 48 h; se expandió el cultivo en 3 botellas con 100 ml de TSA cada una y se incubaron a 37°C por 48 h. Se recolectaron de cada botella las bacterias con 50 ml de PBS estéril (buffer fosfato salino; 150 mM NaCl, 2,5 mM KCl, 1,5 mM KH2PO4, 9 mM Na2HPO4, pH 7,4), se inactivaron por calor 1 h a 56°C, se filtró la suspensión a través de una gasa estéril y se lavó tres veces por centrifugación a 3500 g por 10 min en PBS. Se adicionaron al sedimento 10 ml de PBS, se autoclavó a 120°C bajo 1,5 atmósferas por 20 min y se centrifugó a 12,000 gravedades (g) por 20 min, a 4°C. El sobrenadante se almacenó en alícuotas de 200 µl a -20°C para ser usado posteriormente.
Protocolo 2 (Daltro de Oliveira et al., 2011): Una parte del extracto de proteínas totales obtenidas en el protocolo anterior se sometió a 3 ciclos de sonicación de 60 s cada uno a 40 Hz (Hertz), en un baño de hielo, con 1 min de intervalo entre los ciclos. Se centrifugó a 12,000 g por 20 min a 4°C y el sobrenadante se almacenó en alícuotas de 200 ul a -20°C para ser usado posteriormente.
Protocolo 3 (Connolly et al., 2006): Las cepas se sembraron en 250 ml de TSC, se incubaron a 37°C en agitación por 24 h y se centrifugaron a 8,000 g por 15 min a 4°C. El sedimento se lavó dos veces con buffer salino fosfato (PBS) y se resuspendió en 100 ml de buffer de lisis 1 (15 mM Tris-HCl pH 8,0, 0,45 M sucrosa, 8 mM EDTA, y 0,4 mg/ml lisozima). Las muestras se incubaron por 15 min a 4°C, se centrifugaron a 8,000 g por 15 min y se les adicionaron 3 ml de buffer de lisis 2 [50 mM Tris-HCl (pH 7,6), 5 mM MgCl2, y 2 mM de un inhibidor de proteasas].
Las muestras se sonicaron en hielo utilizando un ciclo continuo de siete pulsos de 1 min y se centrifugaron dos veces a 3,000 g por 15 min. El sobrenadante se centrifugó a 43,500 rpm por 90 min, los sedimentos se recolectaron y se resuspendieron en 50 mM Tris-HCl (pH 7,6) con 2 mM de un inhibidor de proteasas.
Protocolo 4 (Yang et al., 2011): La extracción de proteínas se realizó previamente según lo informado por Henningsen et al. (2002). Brevemente, las bacterias se centrifugaron a 6,000 g durante 10 min a 4°C, se lavaron cuatro veces con PBS frío y se resuspendieron en 50 mM Tris-HCl (pH 7,5). Las células se sometieron a sonicación durante 10 min y se centrifugaron 2,000 g a 4°C durante 10 min. El sobrenadante se mezcló con 10 volúmenes de 0,1 M Na2CO3 (pH 11,0) frío. La mezcla se incubó en un baño de hielo con agitación constante durante 1 h y se centrifugó a 4°C a 46,000 g durante 1 h. Se retiró el sobrenadante y se resuspendió el sedimento con 50 mM Tris-HCl (pH 7,5) y se centrifugó a 4°C a 46,000 g por 2 h. Se descartó el sobrenadante, el sedimento se lisó en tampón de lisis (5 M de urea, 2 M tiourea, CHAPS 2%, 1% SB 3-10, 1% ASB-14, 1% DTT) a temperatura ambiente durante 1 h y se centrifugó a 46,000 g durante 30 min. El sobrenadante se almacenó a -70°C.
Protocolo 5 (Zhao et al., 2011): Se tomaron 200 ml de cultivo celular en la fase de crecimiento estacionario, se recogieron por centrifugación a 4,000 g durante 15 min a 4°C. Los sedimentos se lavaron dos veces con buffer “low-salt” (3 mmol L-1 KCl, 1,5 mmol L-1 KH2PO4, 68 L-1 mmol de NaCl, 9 mmol L-1 NaH2PO4) y se resuspendieron en tampón de sonicación (urea 8 molar, 1% de ditiotreitol, 4% CHAPS y una tableta completa de cóctel inhibidor de proteasa), posteriormente se sonicó en hielo. La solución se mantuvo a temperatura ambiente durante 1 h y se centrifugó a 12,000 g durante 1 h. El sobrenadante fue almacenado a -70ºC hasta su uso.
Determinación de la concentración de proteínas: A cada uno de los extractos obtenidos en el paso anterior, se le realizó la cuantificación de proteínas por el método BCA (ácido bicinconínico) con el estuche comercial de Thermo Scientific. Brevemente, a partir de una curva de estándares de concentración conocida de BSA (albumina sérica bovina), se determinó la concentración de proteínas de cada una de las muestras por espectrofotometría utilizando un lector de ELISA. Se corrió también un SDS-PAGE al 12% para evaluar la calidad de los extractos. De acuerdo a la concentración de proteínas y a la calidad del extracto, se escogió un protocolo para realizar los extractos para proceder con el paso de Western Blot.
Obtención de muestras de suero para el Western Blot: Se utilizaron 50 muestras de suero de caninos clasificados en 4 grupos de acuerdo a los resultados en las pruebas 2ME-PARP y hemocultivo, que se encontraban almacenadas en un banco de sueros del grupo Biogénesis-Vericel, producto de investigaciones anteriores realizadas en caninos de criaderos urbanos y rurales; a todas estas muestras se les realizó previamente 2ME-PARP y hemocultivo en otros estudios (Castrillón-Salazar et al., 2013; Sánchez-Jiménez et al., 2014).
Las muestras de suero se clasificaron en los siguientes grupos:
Grupo 1: suero de caninos con 2ME-PARP negativa y hemocultivo negativo.
Estandarización de la prueba de Western Blot: Con las proteínas extraídas por los cinco protocolos, se evaluó cuál era el mejor protocolo de extracción y cuál era el peso molecular aproximado de las proteínas inmunorreactivas.
Se realizó un gel de SDS-poliacrilamida al 12% con un gel concentrador al 5% (MacPhee 2010), se sembraron 150 ug de proteína con buffer de carga y se puso a migrar a 100 voltios por 30 min y posteriormente a 120 voltios por 1 h aproximadamente, se usó como marcador de peso molecular de proteínas Precision Plus Protein™ dual color (Biorad, Hercules, CA, USA).
Posteriormente, se realizó la transferencia de las proteínas a una membrana de nitrocelulosa utilizando el equipo de transferencia húmedo de Biorad Mini-Protean Tetra Cell y el Módulo Trans-Blot, con un buffer de corrida de Tris-HCL 25 mM, 192 mM glicina y 20% metanol (Towbin et al., 1979) a 100 voltios por 1 h. Después de la transferencia, la membrana fue bloqueada con 100 ml de buffer de bloqueo TBS-T 1x (tris buffer fosfato más tween 20% al 0,5%) con leche descremada al 5%, a 4°C toda la noche. Posteriormente, las membranas se lavaron tres veces por 5 min con TBS-T.
Luego se verificó la presencia de proteínas en la membrana con el colorante Ponceau y fue cortada en tirillas, cada tirilla se puso a reaccionar con un “pool” de sueros de cada uno de los grupos mencionados anteriormente, se incubaron a 37°C durante 1 h con varias diluciones 1:100, 1:200 y 1:500 del “pool” de sueros de cada uno de los grupos, estos fueron los anticuerpos primarios de la reacción. Posteriormente, cada tirilla se lavó de nuevo con TBS-T tres veces por 5 min y se incubó con anticuerpos anti IgG de perro conjugado con peroxidasa de rábano picante, se ensayaron dos diluciones 1:5,000 y 1:10,000 y se incubaron por 1 h a 37°C. Después, las tirillas se lavaron cuatro veces por 5 min con TBS-T y se agregó como sustrato una solución con DAB (1 mg/ml diaminobenzidina y 0,25 ul/ml de H2O2 al 30% en PBS-T), hasta desarrollar color.
Finalmente, el gel que fue transferido se tiñó con azul de Coomassie y se decoloró con solución desteñidora (agua, metanol y ácido acético).
Los ensayos de estandarización se realizaron para cada condición modificada por duplicado.
Se determinó visualmente el peso molecular de las proteínas de interés comparando con el marcador de peso molecular y a partir del análisis de los resultados de cada grupo de sueros. Se estableció si las proteínas identificadas correspondían al mismo peso molecular o si eran diferentes para cada grupo.
Determinación de la sensibilidad y especificidad de la prueba de Western Blot: Luego de tener estandarizada la prueba, en un análisis ciego se evaluó su sensibilidad y especificidad frente a la prueba 2ME-PARP y el hemocultivo, realizando el Western Blot a 10 sueros de cada grupo (en total 50 pruebas).
Análisis estadístico: A partir de tablas de 2x2 comparando los resultados de la prueba de Western Blot frente al 2ME-PARP o hemocultivo y utilizando el software SPSS versión 22, se determinaron los valores de Sensibilidad (S), Especificidad (E), Valor Predictivo Positivo (VPP) y Valor Predictivo Negativo (VPN). Se establecieron también los intervalos para cada uno de estos valores con un nivel de confianza del 95% y la concordancia de las pruebas mediante la determinación del Índice Kappa.
Aval del comité de ética: Este trabajo fue autorizado para su realización por el Comité de Ética Animal de la Universidad de Antioquia, acta No. 77 del 12 de junio de 2012.
Resultados y Discusión
Extracción y cuantificación de proteínas: De los cinco métodos utilizados y posterior a la cuantificación de la concentración de proteínas, se estableció que el mejor protocolo fue el propuesto por Zhao et al. (2011).
Prueba de Western Blot: Se utilizó para la realización de las pruebas de Western Blot, el extracto proteico de la cepa B. canis str. Oliveri, pues esta cepa se aisló de un canino de Medellín. Con el extracto proteico escogido, se estandarizaron las condiciones para la realización de la prueba de Western Blot; el suero de los caninos se estandarizó a una dilución de 1:500 y una dilución del anticuerpo secundario anti IgG canino de 1:6,000.
Se probaron 50 sueros divididos en los 4 grupos previamente mencionados. Los resultados de 2ME-PARP, Hemocultivo y Western Blot se pueden ver en la Tabla 1.
Determinación de la sensibilidad, especificidad de la prueba de Western Blot: A partir de los resultados presentados en la Tabla 1, se encontró que ciertas bandas fueron específicas para cierto grupo de muestra. Por lo anterior, se dividió el resultado del Western Blot como muestras positivas a bandas de bajo peso molecular (12, 18 y 20 kDa), muestras positivas a las bandas 48 y 70 kDa y muestras positivas a las bandas de 40 y 55 kDa.
Todas las muestras fueron positivas a la banda de 65 kDa, por lo cual esta se consideró una banda inespecífica. En la Figura 1 se observa el gel y el Western Blot para sueros del grupo 2. (Figura 1)
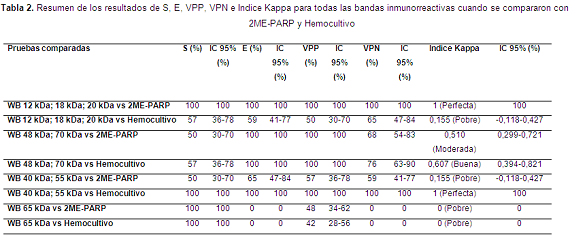
En la Tabla 2 se pueden observar los resultados de S, E, VPP, VPN e Índice Kappa para cada grupo de bandas evaluadas por Western Blot. Tabla 2
Haga clic sobre la imagen para ampliarla
Cuando se compararon bandas de bajo peso molecular frente a los resultados de hemocultivo, 29 (58%) de las muestras tuvieron resultados concordantes.
Cuando se compararon las bandas de 48 y 70 kDa frente al hemocultivo, 41 (82%) de las muestras tuvieron resultados concordantes.
Cuando se compararon las bandas de 40 y 55 kDa frente al 2ME-PARP, 29 (58%) de las muestras tuvieron resultados concordantes.
En la actualidad existen varias pruebas de diagnóstico disponibles para la detección de la infección causada por Brucella canis tanto en perros como en humanos, sin embargo estas pruebas no son lo suficiente sensibles y específicas (Erdenliğ et al., 2011). En este trabajo se encontró que dependiendo del estadio de la infección del canino, el cual se estableció analizando los resultados de las pruebas 2ME-PARP y hemocultivos, hay un grupo específico de bandas inmunorreactivas. En el caso de presentar inmunorreactividad con las bandas de 12, 18 y 20 kDa se podría afirmar que el canino presenta una infección aguda, pero si en el Western Blot se observan bandas inmunorreactivas de alto peso molecular como las de 40, 48 y 55 kDa se podría decir que el canino está en una etapa crónica de la infección.
El perfil del grupo dos, positivo para ambas pruebas, reveló que las bandas específicas para este grupo son las bandas 48 kDa y 70 kDa (Figura 2); algunas de las bandas reportadas inmunorreactivas en este estudio habían sido identificadas previamente por Daltro de Oliveira et al. en el 2011, quienes reportan seropositividad para B. canis con las bandas de 18 kDa, 39 kDa, 62 kDa y 78 kDa, pesos muy similares a los encontrados en este trabajo.
En los estudios realizados por Serikawa et al. en 1989 y Barrouin-Melo et al. en 2007 describen una banda de proteína 65 KDa, relacionada con la seropositividad de los caninos; a diferencia de ellos, en este trabajo se encontró esta banda en cada uno de los grupos estudiados, por lo cual esta banda puede ser una proteína inmunorreactiva del hospedero. Sin embargo, la diferencia de estos hallazgos se puede deber a la diferencia de la cepa bacteriana utilizada para realizar los dos trabajos, pues los otros autores emplearon la cepa M- y en el presente trabajo se utilizó una cepa silvestre aislada de un canino de criadero de la ciudad de Medellín (Castrillón-Salazar et al., 2013).
Delpino et al. (2004) reportaron bandas inmunorreactivas de 6, 22, 30, 42 y 60 kDa, de estas bandas en el presente trabajo se encontró similitud con las bandas de 18, 45 y 65 kDa, aunque ellos no especifican la relación con pacientes sanos o infectados.
También Barka et al. en 2011 reportaron bandas inmunorreactivas en un rango entre 18 y 80 kDa (18, 28, 45, 68, 70 y 80 kDa), y otras bandas inmuno-dominantes de 12, 28, 39 y 45 kDa, estas bandas tienen similitud con las bandas encontradas en el presente estudio.
Finalmente, se concluye que esta prueba podría complementar el diagnóstico de la infección por Brucella canis en caninos, en casos en los cuales el hemocultivo no esté disponible pero sí el 2ME-PARP, pues el Western Blot tiene muy buena sensibilidad y podría detectar anticuerpos en bajos concentraciones, lo cual con aglutinación podría ser difícil en algunos casos. Comparando con el hemocultivo, la utilidad del Western Blot sería aún mayor, pues en casos en los cuales por la intermitencia de la bacteremia la bacteria no pueda ser detectada por hemocultivo, el Western Blot sí podría detectar anticuerpos circulantes y así se podría diagnosticar la infección. Además, el Western Blot sería de mucha utilidad en el seguimiento de caninos con fuerte sospecha de infección por contacto con caninos infectados pero con serología negativa, puesto que el Western Blot sería positivo más rápido que la aglutinación por lo ya mencionado anteriormente, la capacidad de detectar títulos de anticuerpos circulantes más bajos que la prueba 2ME-PARP.
Conclusiones
Este trabajo permitió identificar la inmunorreactividad de sueros de caninos infectados frente a bandas de 48 y 70 kDa, las cuales al compararse con los resultados de 2ME-PARP y el hemocultivo presentaron una concordancia moderada y buena, respectivamente.
Agradecimientos
A la Dra. Zulma Tatiana Ruiz directora del grupo Biogénesis por los recursos asignados a este proyecto dentro de la estrategia de sostenibilidad 2013-2014 del grupo Biogénesis, y a COLCIENCIAS por la financiación de una joven investigadora.
Referencias Bibliográficas
· Barka, S.; Dharmendra, K.; Dhirendra, S. Immunochemical characterization of antigens of Brucella canis and their use in seroprevalence study of canine brucellosis. Asian Pacific Journal of Tropical Medicine, v.4, n.11, p.857-861, 2011. · Barrouin-Melo, S.M.; Padilla Poester, F.; Borges Ribeiro, M. et al. Diagnosis of canine brucellosis by ELISA using an antigen obtained from wild Brucella canis. Research in Veterinary Science, v.83, p.340-346, 2007. · Carmichael, L.E. Abortion in 200 Beagles. Journal of the American Veterinary Medical Association, p.149-1126, 1966. · Carmichael, L.E.; Joubert, J.C. A rapid slide agglutination test for the serodiagnosis of Brucella canis infection that employs a variant (M-) organism as antigen. Cornell Veterinarian, v.77, p.3 12, 1987. · Carmichael, L.E.; Shin, S.J. Canine brucellosis: a diagnostician’s dilemma. Seminars in veterinary medicine and surgery (Small Anim), v.11, p.161-165, 1996. · Castrillón-Salazar, L.; Giraldo-Echeverri, C.A.; Sánchez-Jiménez, M.M.; Olivera-Ángel, M. Factores asociados con la seropositividad a Brucella canis en criaderos caninos de dos regiones de Antioquia, Colombia. Cadernos de Saúde Pública, v.29, p.1955-1973, 2013. · Connolly, J.P.; Comerci, D.; Alefantis, T.G. et al. Proteomic analysis of Brucella abortus cell envelope and identification of immunogenic candidate proteins for vaccine development. Proteomics, v.6, p.3767-3780, 2006. · Daltro de Oliveira, M.Z.; Vale, V.; Keid, L. et al. Validation of an ELISA method for the serological diagnosis of canine brucellosis due to Brucella canis. Research in Veterinary Science, v.90, p.425-431, 2011. · Delpino, M.V.; Fossati, C.A.; Baldi, P.C. Occurrence and Potential Diagnostic Applications of Serological Cross-Reactivities between Brucella and Other Alpha- Proteobacterias. Clinical and Vaccine Inmunology, v.11, n.5, p.868-873, 2004. · Erdenliğ, M.S.; Sayán, M.; Etiler, N. Investigation of Brucella canis seropositivity by in-house slide agglutination test antigen in healthy blood donors. Mikrobiyoloji Bülteni, v.45, n.4, p.655-63, 2011. · Jacob, N.R.; Rodríguez, C.G.; Binaghi, M.A. et al. Brucellosis complicating chronic non-infectious disorders: diagnostic and therapeutic dilemmas. Journal of Medical Microbiology, v.57, p.1161-1166, 2008. · Lucero, N.E.; Ayala, S.M.; Escobar, G.I.; Jacob, N.R. The value of serologic tests for diagnosis and follow up of patients having brucellosis. American Journal of Infectious Diseases, v.3, p.27-35, 2007. · Lucero, N.E.; Escobar, G.I.; Ayala, S.M. et al. Sensitivity and specificity of an indirect enzyme-linked immunoassay for the diagnosis of Brucella canis infection in dogs. Journal of Medical Microbiology, v.51, p.656-660, 2002. · Lucero, N.E.; Jacob, N.; Ayala, S.M. et al. Unusual clinical presentation of brucellosis caused by Brucella canis. Journal of Medical Microbiology, v.54, p.505-508, 2005. · Lucero, N.E.; Tenenbaum, M.; Jacob, N.R. et al. Application of variable number of tandem repeats typing to describe familial outbreaks of brucellosis in Argentina. Journal of Medical Microbiology, v.59, p. 648-652, 2010. · MacPhee, D.J. Methodological considerations for improving Western blot analysis. Journal of Pharmacological and Toxicological Methods, v.61, p.171-177, 2010. · Olivera, M.; Di-Lorenzo, C. Aislamiento de Brucella canis en un humano conviviente con caninos infectados. Informe de un caso. Colombia Médica, v.40, n.2, 2009. · Olivera, M.; Giraldo, C.A.; Di-Lorenzo, C. Identificación por PCR de Brucella canis en sangre y leche canina: Reporte de un caso. Archivo Médico Veterinario, v.43, n.3, p.295-298, 2011. · Rovid, S.A.; Roth, A.J.; Galyon, J.L. et al. Enfermedades Emergentes y Exóticas de los Animales. Primera edición. Center for food security and public health, 2010. · Sánchez-Jiménez, M.M.; Ortiz-Román, L.F.; Castrillón-Salazar, L.L. et al. Application of a polymerase chain reaction test for the detection of Brucella canis from clinical samples of canines and humans. Revista Colombiana de Ciencias Pecuarias, v.27, p.3-11, 2014. · Serikawa, T.; Iwaki, S.; Mori, M. et al. Purification of a Brucella canis cell wall antigen by using immunosorbent columns and use of the antigen in enzyme-linked immunosorbent assay for specific diagnosis of canine brucellosis. Journal of Clinical Microbiology, v.27, n.5, p.837-842, 1989. · Towbin, H.; Staehelin, T.; Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proceedings of the National Academy of Sciences, v.76, n.9, p.4350-4354, 1979. · Wanke, M.M. Canine brucellosis. Animal Reproduction Science, v.82-83, p.195-207, 2004. · Yang, Y.; Wang, L.; Yinc, J. et al. Immunoproteomic analysis of Brucella melitensis and identification of a new immunogenic candidate protein for the development of brucellosis subunit vaccine. Molecular Immunology, v.49, p.175-184, 2011. · Zhao, Z.; Yan, F.; Ji, W. et al. Identification of immunoreactive proteins of Brucella melitensis by immunoproteomics. Science China Life Sciences, v.54, p.880-887, 2011.
Ospina-Flórez, B.L.; Beltrán-Agudelo, M.; Duque-Valencia, J.; Sánchez-Jiménez, M.M.; Olivera-Ángel, M. Desarrollo de una prueba de Western Blot para la detección de Brucella canis en perros. Veterinaria y Zootecnia, v.8, n.1, p.99 -111, 2014. < http://200.21.104.25/vetzootec/index.php?option=com_content&view=article&id=115> |