|
Catabolismo de los anticuerpos maternales y duración de la inmunidad vacunal de las bacterinas contra (Mycoplasma hyopneumoniae) en cerdos
REVISIÓN DE
(Recibido: 25 de Febrero 2014 Aprobado: 30 de Abril de 2014 Actualizado: 19 Noviembre de 2014)
RESUMEN: La Neumonía enzootica (Ne) es una de las enfermedades respiratorias de los cerdos que genera grandes pérdidas económicas, es causada por la bacteria Mycoplasma hyopneumoniae (Mh); los últimos estudios en centrales de sacrificio a nivel mundial han reportado que cerca de 50% de los cerdos sacrificados presentan lesiones características de una infección asociada a Mh. Las afecciones en los pulmones observadas en animales a sacrificio están ubicadas en la parte ventral de los lóbulos apical, cardiaco y diafragmático en un promedio aproximado de 40-50%. El Mh se localiza en la superficie de la mucosa de la tráquea, bronquios, bronquiolos, específicamente en el ápice de los cilios, cuando la neumonía es causada solo por el Mh los daños son moderados, se presenta disminución en el promedio de la ganancia de peso día, aumento de la conversión alimenticia, pero si se presentan coinfecciones por otras bacterias se exacerba la enfermedad y causa un complejo denominado complejo respiratorio porcino (PRDC) que se caracteriza por presentar una bronconeumonía aguda y posiblemente la muerte. La vacunación contra Mh demuestra ser efectiva, reduciendo las lesiones en los pulmones y mejorando las ganancias de peso por día, la conversión alimenticia, pero no elimina al Mycoplasma hyopneumoniae, ni la infección. El objetivo de la revisión de literatura es analizar la respuesta del sistema inmune del cerdo al Mycoplasma hyopneumoniae, y evaluar la respuesta de las vacunas y calendarios de vacunación.
Palabras clave: Neumonía, lóbulos, Mycoplasma, hyopneumoniae
Catabolism of maternal antibodies and duration of vaccine immunity of bacterins against (Mycoplasma hyopneumoniae) in pigs
ABSTRACT: The enzootic pneumonia is a respiratory disease of pigs that generates major economic losses. It is caused by the Mycoplasma hyopneumoniae (Mh) bacteria; recent studies in slaughter plants worldwide have reported that about 50% of the slaughtered pigs present characteristic lesions of an infection associated with MH. The lung problems observed in pigs for slaughter are located in the ventral part of the apical, diaphragmatic and cardiac lobules, in an approximate average of 40-50%. The Mh is located on the mucosal surface of the trachea, bronchi and bronchioles , specifically in the apex of the cilia. When pneumonia is caused only by Mh damage is moderate, and decline occurs in day weight gain, there is increase in feed conversion, but if co-infections occur produced by other bacterias the disease exacerbates and causes a complex called porcine respiratory disease complex (PRDC) that is characterized by an acute bronchopneumonia and possible death. Vaccination against Mh shows to be effective reducing lung injury and improving weight gain and feed conversion, but does not eliminate Mycoplasma hyopneumoniae or the infection. The objective of the literature review is to analyze the pigs’ immune response to, Mycoplasma hyopneumoniae and asses response of the vaccines and vaccination schedule.
Key words: Pneumina, Lobules, Mycoplasma, hyopneumoniae.
Introducción
Mycoplasma hyopneumoniae
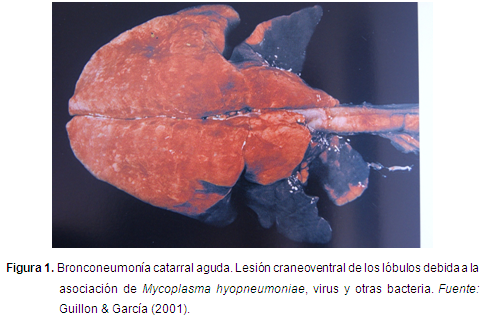
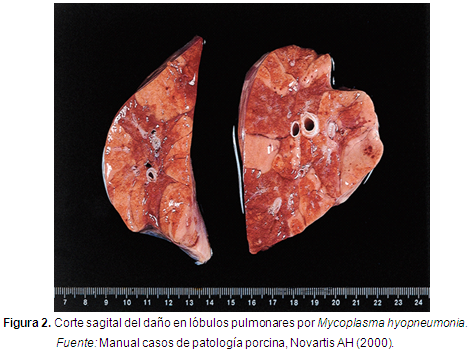
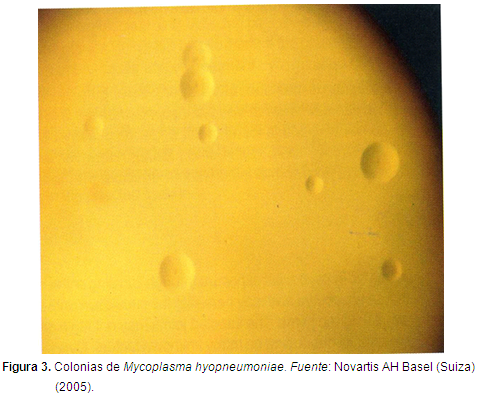
Mh es el agente etiológico causante de la Neumonía enzootica (Ne). Es una bacteria que se caracteriza por no poseer pared celular, lo que la hace muy sensible a la lisis medida por anticuerpos (Calsamiglia, 2004). Es miembro de la clase Mollicutes, familia Mycoplasmataceae, y al género Mycoplasma, relacionado filogenéticamente con las bacterias gram-positivas (Tully et al., 1989). Se presenta en forma de colonias apenas visible a los 2-3 días de incubación, pero luego de 10 días incrementa su tamaño de 0,25-1 mm (Ross, 1989). Su genoma es pequeño (1070 bp) (Minion et al., 2002) (Figura 3). Los últimos reportes en centrales de sacrificio, informan que el 50% de los cerdos sacrificados presentan lesiones patológicas compatibles con Mycoplasma hyopneumoniae (Ross, 1999). Por lo anteriormente planteado también se deteriora la ganancia de peso diaria. El objetivo de la siguiente revisión de literatura es evaluar la respuesta del sistema inmune del cerdo desde su nacimiento hasta que es enviado a la central de sacrificio, y cómo responde la inmunidad celular a la vacunación con bacterianas contra el Mh (Figura 1, 2,3).
El sistema inmune del cerdo
El sistema inmunitario está constituido por el sistema retículo endotelial (SER), que lo componen los órganos linfáticos primarios como la médula ósea y el timo, los órganos linfáticos secundarios que son el bazo, nódulos linfáticos y ganglios, es aquí donde los linfocitos reconocen los antígenos para generar una respuesta inmune; porcentualmente las células del sistema inmune están distribuidas así: linfocitos T 55%, linfocitos B 15%, y linfocitos T Null 30% (Madigan & Martinko, 2006).
En las placas de Peyer ubicadas en el intestino se atrapan los antígenos, estos estimulan las células T y B que se encuentran en los nódulos linfáticos, los cuales migran a través de vasos linfáticos hacia la sangre y otras mucosas como la respiratoria y la glándula mamaria. Esto explica porque cuando se inmuniza la hembra gestante por vía oral, se obtienen anticuerpos en el calostro (Garfinas et al., 1992).
Inmunidad pasiva
Transferencia de anticuerpos de la madre al lechón
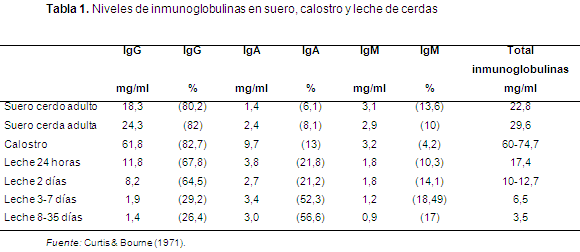
En los porcinos no es posible la transmisión de inmunoglobulinas (Ig) de la madre al lechón a través de la placenta, esto se debe al tipo de placentación que se denomina epitelio corial difusa; y a las seis capas de tejido que hay entre la sangre fetal y la sangre materna; además, a la ausencia de receptores de IgG para hacer el transporte de IgG, por lo tanto la inmunidad es pasada de la madre al lechón a través del calostro, el cual contiene el 80% de las IgG presentes en el calostro (Curtis & Bourne, 1971).
Absorción de inmunoglobulinas
Las cerdas que han sido vacunadas contra Mh pasan los anticuerpos a su progenie a través del calostro (Burch, 2002); los lechones absorben los anticuerpos principalmente en las primeras 6 horas luego de ingerir el calostro y las células intestinales que absorben las IgG se cierran a las 18 horas post-absorción, en el suero se presentan las IgG hasta las 24 horas de edad; los leucocitos encontrados en el calostro, los macrófagos, neutrófilos y linfocitos que se absorben en las primeras horas de nacidos, tienen efecto protectivo (Bazer et al., 2001).
La vida media de las inmunoglobulinas en los lechones, según Curtis & Bourne, 1971, es de la siguiente manera: las IgG de 6,5-22 días (Tablas 1 y 2), IgM de 2,5-3 días y las IgA de 2-3 días. Por otro lado, las IgA tienen actividad de neutralización de virus e impiden la adherencia de los patógenos a las mucosas, sin embargo no opsonizan bacterias, para generar una alta producción de IgA debe hacerse un fuerte estímulo antigénico, por ejemplo con el virus de la gastroenteritis transmisible (Garfinas et al., 1992).
Inmunidad activa
Defensas no-específicas
El cuerpo de los cerdos tiene un gran número de mecanismos de defensa no específicos para destruir las bacterias que entran al organismo, ellas inician una cadena de eventos para estimular la inmunidad pasiva, la activa y la mediada por células. Ellas son: barreras físicas como piel y mucosas, barreras químicas como mucus, lisozimas y jugos gástricos, sustancias antimicrobianas como transferrinas, interferones los cuales incrementan la fagocitosis, y el complemento que activa la cascada de la inflamación y causa lisis de paredes bacterianas. Componentes celulares como los natural killers que no poseen receptores antigénicos y que eliminan virus y células tumorales, neutrófilos que son las primeras células de defensa y macrófagos (Tortora & Grabowski, 1996).
La fagocitosis es el mayor componente de defensa del cuerpo (sistema retículo endotelial); por quimiotaxis se atraen los microbios, luego se activa el complemento y la inflamación, el fagocito (macrófago) captura el microbio, el fagosoma lo digiere y destruye, los remanentes son terminados de destruir por péptidos producidos por el MHC II (complejo mayor de histocompatibilidad), y de esta forma puede ser presentado a los linfocitos para desarrollar la inmunidad específica; los macrófagos producen citoquinas e interleucinas para desarrollar la inmunidad humoral (IL-1, IL2, IL-6, IL-10, IL-12; IL-18) y el factor de necrosis tumoral (TNF-a) el cual regula la respuesta celular (Burch, 2002).
Inflamación
La inflamación juega un papel importante en la reacción de defensa del sistema inmune, al generar dolor, rubor, hinchazón y disminución de las funciones vasculares causando vasodilatación, esto incrementa la permeabilidad sanguínea permitiendo la migración de los fagocitos a los tejidos a reparar, todo esto se realiza bajo el control de sustancias químicas como la histamina, las quininas, prostaglandinas, leucotrienos y el complemento (Murray & Mayes, 2004).
Aunque en la Neumonía enzootica la reacción es relativamente baja, hasta que se produzca una invasión bacteriana fuerte, esto puede explicar porque se produce inflamación en una infección crónica; otra consideración importante es la respuesta a la vacuna de Mh el nivel de reacción en el sitio de la vacuna, la viabilidad, la cantidad del antígeno estimulan la respuesta inmune (Burch, 2002).
Células linfocitarias-Inmunidad humorales (linfocitos B y células plasmáticas)
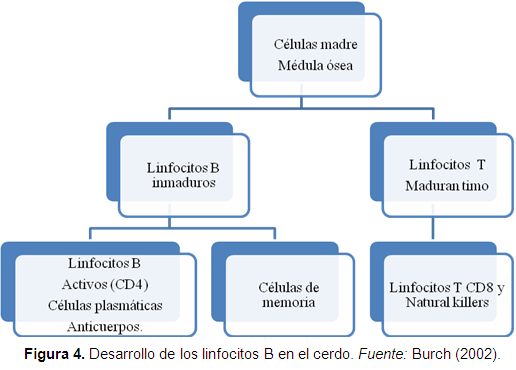
Los linfocitos son formados en la médula ósea en los huesos; los linfocitos B maduros, son inactivos pero desarrollan sitios de reconocimiento de antígenos (Ag), ellos se llegan a activar por un antígeno o por los linfocitos T; la estimulación antigénica llega a formar las células plasmáticas, las cuales se multiplican hasta formar clones de anticuerpos. Otras llegan a convertirse en células de memoria para responder a un segundo ataque o responder a una vacunación (Suradhat et al., 2005).
Los anticuerpos se unen al Ag y los inactivan, las IgM se producen en un 5-10% del contenido sanguíneo de Ig, es el primer anticuerpo de respuesta que aparece usualmente 5-10 días luego de la exposición. La IgG se presenta en mayor cantidad con 60-75% en sangre, aparece entre los 10-14 días y estimula la fagocitosis, neutraliza toxinas y desencadena el complemento, especialmente protegiendo las membranas mucosas y riñones, especialmente en la Neumonía enzoótica ya que el Mh es un organismo que se localiza en la mucosa traqueal (Suradhat et al., 2005; Kaser et al., 2008) (Figura 4).
Células linfocitarias-Inmunidad celular. (Linfocitos T, células ayudadoras CD4 y células citotóxicas CD8).
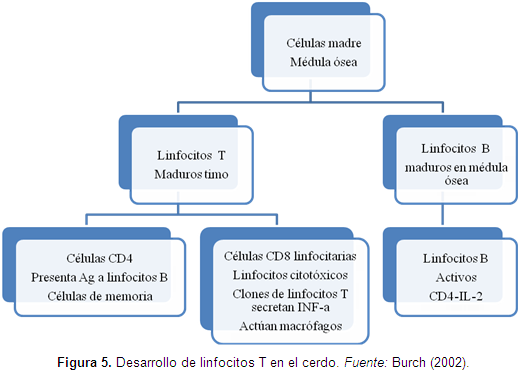
Los linfocitos T se producen de en la médula ósea de los huesos, pero llegan a la madurez en el timo y desarrollan receptores de Ag en diferentes tipos de células antes de llegar al sistema linfoide, las mayores células de este tipo son las CD4 o células ayudadoras y CD8 o células citotóxicas que atacan células que contienen antígenos extraños como virus o bacterias o células tumorales (Jensen & Christensen, 1981; Suradhat et al., 2005; Kaser et al., 2008) (Figura 5).
Inmunidad específica
La importancia del mecanismo de defensa específico en los cerdos, radica en que puede distinguir entre Ag propios o extraños, y usualmente para dar una respuesta antigénica toma alrededor de 11 días para responder, una vez la respuesta de memoria puede activarse rápidamente cuando encuentra los clones de células de memoria alrededor de los 4 días después de la primera respuesta (Burch, 2002).
Desarrollo del sistema inmune del cerdo
Los cerdos adquieren su inmunocompetencia durante la vida embrionaria, la cual se divide en tres fases.
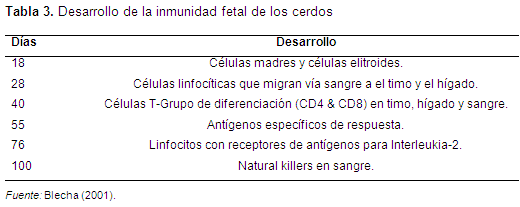
Periodo refractario: se extiende hasta los 45 días de gestación, se caracteriza por la diferenciación de los órganos linfáticos, el timo se forma a los 30 días y los primeros linfocitos a los 38 días, a los 40 días hay linfocitos en los ganglios linfáticos (Garfinas et al., 1992; Blecha, 2001).
Periodo de tolerancia: es un periodo que se da a los 60 días y donde el feto responde a estímulos antigénicos primarios (Garfinas et al., 1992).
Periodo de respuesta: aparecen las primeras reacciones inmunes, y es mayor a los 60 días de gestación, se caracteriza porque aparecen las IgM (Garfinas et al., 1992; Blecha, 2001).
Finalmente, es muy importante tener en cuenta que en el momento del parto la capacidad bactericida y fagocita de los leucocitos, disminuye como resultado de un incremento de los glucocorticoides fetales, por esta razón los macrófagos disminuyen su capacidad fagocita (Curtis & Bourne, 1971) (Tablas 3 y 4).
Efecto de las vacunas contra Mycoplasma hyopneumoniae
La respuesta inmune de los lechones neonatos en general difiere cualitativamente y cuantitativamente de los cerdos adultos por dos razones. Primero, se debe a una combinación de un sistema inmune inmaduro a uno desarrollado completamente; y segundo, a el efecto supresivo de los anticuerpos maternales (Siegrist, 2001).
La edad en la que los lechones neonatos pueden llegar a ser inmunocompetentes, para responder a un antígeno específico con una buena masa antigénica, varía con la especie y el Ag de interés (Banks & McGuire, 1989).
En los cerdos los anticuerpos maternales inhiben la repuesta antigénica a vacunación contra virus o bacterias (Siegrist et al., 1998).
Los efectos de los anticuerpos maternales sobre la respuesta inmune depende de la cantidad de anticuerpos absorbidos en el calostro y de la vida media de esos anticuerpos; la respuesta a las vacunaciones es más eficiente cuando el sistema inmune madura y los anticuerpos maternales se catabolizan (Hodgins & Shewen, 1998).
Efecto de los anticuerpos maternales sobre la edad y la respuesta vacunal
Es de vital importancia tener en cuenta la tasa metabólica de reducción de los anticuerpos; en los cerdos el catabolismo de los anticuerpos maternales para Mh es de 15,8 días (Ross, 1989).
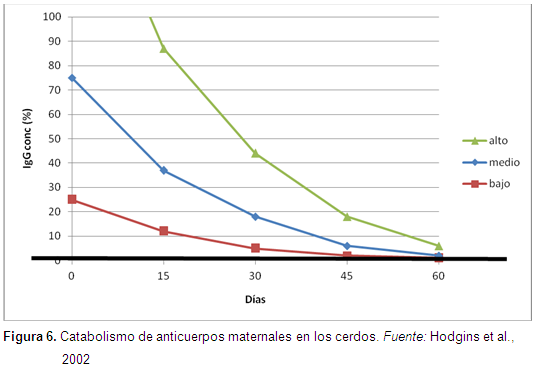
En un reporte, Hodgins et al. (2002) observaron el efecto de los anticuerpos maternales en lechones hijos de cerdas vacunadas y no vacunadas, 2 semanas antes del parto. Los lechones de ambos grupos fueron vacunados a las 2, 3 y 4 semanas de edad. Se tomaron muestras de sangre antes de la vacunación y 3 semanas después para ver el nivel de anticuerpos en suero sanguíneo. El estudio reportó que los lechones hijos de cerdas vacunados tenían un alto nivel de anticuerpos maternales vs los no vacunados, también se demostró que los anticuerpos de los cerdos de madres vacunados no descendió tan rápidamente como los de los no vacunados, y dichos anticuerpos en cerdos de madres vacunadas ante-parto persistían por 2,5 meses (Figura 6).
Efecto protectivo de las vacunas contra M. hyopenumoniae
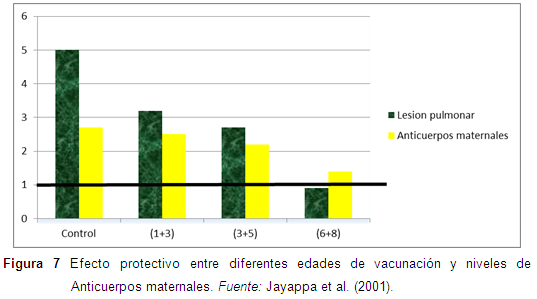
Se realizó un estudio para evaluar la respuesta vacunal de la siguiente forma. Se vacunaron lechones en el siguiente calendario, a las 1+3 semanas, 3+5 semanas, 6+8 semanas de edad, y los lotes no vacunados fueron los controles. Se realizaron serologías al final de la primera vacunación para determinar el nivel de anticuerpos maternales contra Mh. Los cerdos fueron desafiados a las 16 semanas de edad intratraquealmente, y se realizaron las necropsias a las 21 semanas de edad, y se evaluaron la lesiones pulmonares (Jayappa et al., 2001).
Las conclusiones del trabajo fueron que las lesiones pulmonares se redujeron considerablemente con la vacunación a la 1+3 semanas de edad. La vacunación a la 3+5 semanas no mostró diferencia significativa comparada con los otros tratamientos. Los anticuerpos maternales disminuyeron su eficacia en presencia de la vacuna, una cantidad alta de anticuerpos maternales no previene el desafío tardío a una micoplasmosis. La vacunación de las cerdas se puede considerar que pueden dar un impacto negativo sobre la protección de los cerdos, a través de su vida productiva (Jayappa et al., 2001) (Figura 7).
Respuesta vacunal a dos dosis de Mycoplasma hyopneumoniae
Cuando se realiza un plan vacunal contra Mh, con dos dosis, se deben considerar variables como son: el sistema de producción, los cambios medioambientales, los desafíos virales y bacterianos (Burch, 2002).
Un programa de dos dosis de vacuna contra Mh es recomendable en las siguientes condiciones: alta presión de enfermedades tales como PRRS (Síndrome reproductivo y respiratorio porcino), inmunidad inestable en cerdos jóvenes, mezcla de diferentes madres o diferentes granjas, multisitios, flujo continuo poco confiable (Burch, 2002).
El programa vacunal que se ha usado exitosamente en el Reino Unido es a la primera semana la primera dosis, y a la cuarta semana la segunda dosis. La primera vacunación a la semana de edad puede reducir los anticuerpos maternales, y la segunda dosis a la cuarta semana realiza un mejor trabajo; la inmunidad pasiva o anticuerpos maternales son muy importantes, ellos pueden neutralizar la vacuna de la primera semana haciéndola inefectiva (Burch, 2002; Hodgins et al., 2002).
Se realizó un programa con doble dosis de la vacuna Stellamune. El grupo vacunado presentó un índice neumónico de 1,4% en planta de sacrificio, que se interpretó como una reducción significativa comparado con los controles no vacunados (P<0,023); la respuesta serológica fue del 55% a las dos dosis de vacuna y un 100% de seroconversión en respuesta al desafío, y los parámetros zootécnicos fueron: ganancia promedio día de 717 g, y la conversión alimenticia de 2.78, el 3,43% de mortalidad y 127 días de salida al mercado (Sanford, 2002).
Otra prueba comparó la protección de cuatro vacunas comerciales, donde se utilizó un programa contra Mh con dos dosis, la primera dosis a las dos semanas de edad y la otra dosis a las cinco semanas, y se desafiaron contra Mh a las 12 semanas después de la vacunación. Se realizó un análisis de las lesiones pulmonares cuatro semanas después. Los resultados mostraron que existe diferencia significativa entre los lotes vacunados en comparación con el control; una de las vacunas presentó mejor protección al reducir las lesiones pulmonares en un 93% (Thacker et al., 1998).
Respuesta vacunal a una dosis de Mycoplasma hyopneumoniae
De acuerdo al monitoreo serológico para Mh en cerdos vacunados a la cuarta semana de vida y su seguimiento desde el nacimiento hasta la semana 14 de vida, se observó que los anticuerpos para esta etapa disminuyeron continuamente (Aricapa et al., 2010).
Lo más importante para tener en cuenta en la fecha de vacunación, son los títulos de anticuerpos maternales del lechón en el momento de la aplicación de la vacuna. Se observó que lechones con títulos maternales moderados, vacunados con una sola dosis de vacuna contra Mh, desarrollaron una mejor respuesta vacunal que aquellos que tenían una alta inmunidad maternal (Marco, 2004).
Sin embargo, se considera que la aplicación de una sola dosis de vacuna en los lechones a la semana de edad no impide la colonización del Mh, pero sí la reducción de las lesiones pulmonares analizadas post-mortem, en las lesiones halladas en matadero a las 25 semanas de edad (Maes et al., 2008; Reynolds, et al., 2009).
Para evaluar la respuesta de los cerdos al efecto protector de una sola dosis de vacuna según la edad y el nivel de anticuerpos maternales, se tomaron lechones de madres vacunadas contra Mh y lechones de madres no vacunadas, y ambos grupos se vacunaron con una sola dosis de Mh a las 3, 6, 9 semanas de edad; en la fecha de vacunación se realizó serología para analizar los anticuerpos maternales, se desafiaron a las 14 semanas de edad, y luego se realizó necropsia a las 18 semanas, en general se observó una tendencia a disminuir las lesiones pulmonares en los tres grupos, especialmente en los vacunados a la tercera y novena semana de vida (Thacker et al., 2002).
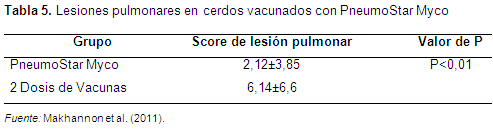
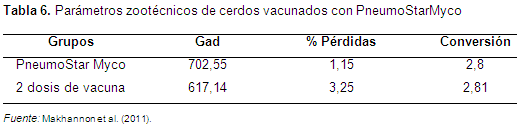
Otra forma de evaluar la efectividad de la aplicación de una sola dosis de vacuna es analizando las ganancias diarias frente a las lesiones pulmonares. Makannon et al. (2011) realizaron un experimento en lechones hijos de 2000 madres con dos grupos, los lechones hijos de 1000 madres vacunados con una sola dosis de Mh y el otro grupo con dos dosis; se observó que en los cerdos vacunados con una sola dosis las ganancias día en promedio fueron de 702,55 g/d y las de dos dosis fueron 617,14 g/d, y las lesiones pulmonares fueron para los de una dosis 2,2 y las de dos dosis de 6,17, resultando en un análisis de P<0,01 con diferencias significativas a favor de los vacunados con una sola dosis (Tablas 5 y 6).
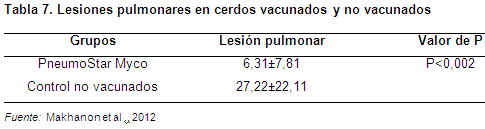
De igual forma, cuando la vacunación de una sola dosis es comparada contra controles no vacunados, las lesiones pulmonares en los vacunados son de 6,31 comparadas con los no vacunados que es de 27,22. Esto demuestra que hay una diferencia significativa a favor de los vacunados (Makhannon et al., 2012) (Tabla 7).
Adyuvantes - efecto sobre el estímulo inmune y la protección
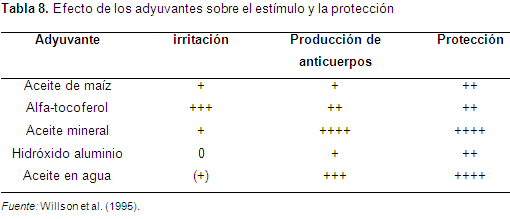
Recientemente ha habido un gran desarrollo en la tecnología de los adyuvantes para las vacunas en los cerdos, pero cada uno tiene sus características que los diferencian, algunos presentan baja reactividad cuando se inyectan pero dan una baja respuesta inmune, como es el caso del hidróxido de aluminio. Otros como el aceite mineral y el alfa-tocoferol presentan una alta reacción en el sitio de inyección por ser muy viscosos. La emulsión de aceite agua da una baja reacción porque se disminuye la viscosidad (Willson et al., 1995) (Tabla 8).
El avance más reciente en la producción de adyuvantes está dado por la emulsión agua/aceite/agua (InmunoStar de Novartis), que genera una respuesta humoral rápida, larga duración de la misma y con muy baja reactividad en el sitio de aplicación (Jansen et al., 2006).
Discusión
Es claro que el cerdo nace con una carga baja de anticuerpos, los cuales son transferidos por el calostro de la madre, que protegen al lechón los primeros días de vida y son del tipo IgM; la respuesta a las vacunas es mediada por las IgG que son expresadas por la inmunidad celular, no existiendo relación entre ellas para dar una protección a un desafío por Mh. Por lo tanto, las vacunas expresarán dicha protección en la fase final del engorde y ella tiene que ver con la carga antigénica y el vehículo usados por ellas, dependiendo además si es un programa de una dosis o dos dosis.
Es fundamental construir una línea base serológica de Mh, para poder ser más efectivos en el diseño del programa vacunal, de él dependen las fechas de aplicación de la vacuna y la respuesta antigénica necesaria.
Conclusiones
Los anticuerpos maternales protegen a los lechones de una infección temprana de Mh, son transmitidos al lechón por el calostro, Se concluye que para proteger al cerdo del Mh debe activarse el sistema inmune ligado a las mucosas; Hodgins et al. (2002) afirman que madres gestantes vacunadas transmitieron una cantidad alta de anticuerpos, para proteger al lechón de un reto temprano. En el diseño del plan vacunal, hay que tener claro que el sistema inmune del cerdo es maduro a la cuarta semana. Además, hay que evaluar el catabolismo de los anticuerpos maternales con la aplicación de la vacuna, para lograr una buena respuesta a las 24 semanas de vida. Los anticuerpos producidos son del tipo IgG, que expresan la inmunidad celular. Es clara la diferencia entre la respuesta humoral y celular. Las vacunas reducen las lesiones pulmonares, e inducen la producción de células de memoria. Los adyuvantes menos irritantes y que generan más protección, son las emulsiones entre el aceite agua.
Agradecimientos
A Betty y Daniela gracias por la paciencia que alimenta el deseo de encontrar la verdad, y a Óscar Betancur que exigió nunca detenerse en la búsqueda de este objetivo.
Referencias Bibliográficas
· Aricapa, J.; Jaramillo, A.; Mesa, H.; Martínez, M.; Suikan, F. Monitoreo serológico para Mycoplasma hyopneumoniae en cerdos, desde el nacimiento hasta la semana 14 de vida. Vet. Zootec, v.4, n.2, p.37-47, 2010. · Banks, K.L.; McGuire, T.C. Neonatal immunology. In: Halliwell, R.E.W.; Gorman, N.T. (Eds). Veterinary clinical immunology. 1st. Philadelfia: Saunders, p.193-204. 1989. · Bazer, F.W.; Ford, J.; Keisenger, R. Reproductive physiology. In: Pond, W.G.; Mersman, H.J. (Eds). Biology of the domestic pigs. Chapter 5. Ithaca: Cornell University Press, p.688-771. 2001 · Blecha, F. Immunology. In: Pond, W.; Mersman, H. (Eds). Biology of the domestic pig. Ithaca: Cornell University press, p.688-711, 2001 · Burch, D.G.S. Paper presented at the schering-Plough launch of M+Pac in the UK 4.5th September. Octagon service Ltda., United Kindom, 2002. · Calsamiglia, M. Mycoplasma hyopneumoniae. Epidemiología y control. Revista Ciencias Veterinarias, p.1-4, 2004. · Curtis, J.; Bourne, F.J. Inmunoglobulin quantitation in sow serum, colostrum and milk and the serum of young pigs. Biochim Biophys Acta, v.236, n.1, p.319-332, 1971. · · Garfinas, B.; Gómez, C.R.; Gonzales, M.; Montenegro, V.; Velarde, F. Inducción de la respuesta inespecífica contra la Fasciola hepática en ovinos con adyuvante completo de Freud. Rev. Mex. Parassitol., 3, p.22-24, 1992. · Guillon, M.; García, A. Guía de necropsia en patología porcina. 2001. Fig. 423, p.86. · Hodgins, D.C; Shewen, PE. Serological response of young colostrum fed dairy calves to antigens of Pasteurella hemolytic A1. Vaccine, v.16, n.20, p.2018-2025, 1998. · Hodgins, D.C.; Shewen, P.E.; Dewey, C.E. Influence of age and maternal antibodies on antibody responses of neonatal piglets to Mycoplasma hyopneumoniae. Proceedings of the International Pig Veterinary Society, Ames, Iowa, USA, 1, 255; 2002. · Jansen, T.; Hofmans, M.P.; Theelen, M.J.; Manders, F.; Schijns, V.E. Structure- and oil type-based efficacy of emulsion adjuvants. Vaccine, v.24, n.26, p.5400-5405, 2006. · Jayappa, H.; Davis, R.; Rapp-Grabielson, V.; Wasmonen, T.; Thacker, E.; Thacker, B. Evaluation of the efficacy of Mycoplasma hyopneumoniae bacterin following immunization of young pigs in the presence of varying levels of maternal antibodies. American Association of Swine Veterinarians, Conference, Nashville, Tennessee, USA, p.237-241. 2001 · Jensen, P.T.; Christensen, K. Genetics studies in vitro PHA-transformation of porcine blood Lymphocities. Veterinary immunology immunopathology, v.2, n.2, p.133-143, 1981. · Kaser, I.; Gerner, W.; Hammer, S.E.; Paltzer, M.; Sallmuller, A. Detection of FoxP3 protein expression in porcine T Lhynphocities. Veterinary immunology immunopathology, v.125, n.1-2, p.92-101, 2008. · Madigan, M.T.; Martinko, J.M. Brock Biology of microorganism. 11th ed. Person, P. p.121-124, 2006 · Maes, D.; Deluker, H.; Verdonck, M.; Castrick, F.; Miry, C.; Vrijens, V.; Verveke, W.; Viaene, J.; de Kruij, A. Effect of vaccination against Mycoplasma hyopneumoniae in pig herds with all-in/all-out production system. Vaccine, v.17, n.9-10, p.1024-1034, 2008. · Makhannon, M.; Sirisinlapakorn, M.; Rittiwegrom, W. Comparative efficacy one –two doses Mycoplasma hyopneumoniae Vaccines to lung score and performance in pigs in field conditions. Novartis (Thailand). Proceedings of the 5ᵗ Asian Pig Veterinary society congress. 7- 9-March; 2011. · Makhannon, M.; Wonkavervit, K.; Rithiwigrom, W. The efficacy of Mycoplasma hyopneumoniae one dose vaccination to lung lesions. Proceedings of IPVS Korea, p.36, 2012. · Marco, E. Mycoplasma hyopneumoniae: elección de la mejor pauta de vacunación. Suis, n.8, 2004. Disponible en: http://www.3tres3.com/buscando/mycoplasma-hyopneumoniae:-eleccion-de-la-mejor-pauta-de-vacunacion_917 Accesado en: 02/02/2007. · Minion, C.; Elliot, J.; Lefkovitz, N.; Maadesen, M.; Clearly, B.; Mahairas, G.C. Mycoplasma hyopneumnoniae, Strain 232, The agent of swine Mycoplasma. Journal bacteriology, v.186, n.21, p.184, 2002. · Murray, R.K.; Mayes, A. Metabolismo de los ácidos grasos e Icosanoides. Bioquímica de Harper. El manual moderno, p.217-225, 2004 · Novartis AH, Colonias de Mycoplasma hyopneumoniae. 2005 · Reynolds, S.C.; St Aubin, L.B.; Kula, J.; Vogelaar, J.; Runnels, P.; Peters, A.R. Reduced lung lesions in pigs Challenged 25 weeks after administration of a single dose of Mycoplasma hyopneumoniae vaccine approximately 1 week of age. The veterinary journal, v.181, p.312-320, 2009. · Ross, R. Mycoplasma diseases. In: Straw, B.; D’Allire S.; Mengeling, W.; Taylor, D. (Eds). Disease of the Swine. 8th ed. Ames, Iowa: Iowa State University Press, p.495-510, 1999. · Ross, R.F. Mycoplasma disease. In: Lemman, A.D. Diseases of the swine. 6th Ed. Ames Iowa State University Press, p.495, 1989 · Sanford, E. Swine Respiratory Health Symposium PRRS/M.hyo. Ingelvac.hyo-North American Experiences, 2002. · Siegrist, C.A. Neonatal and early life vaccinology. Vaccine, v.19, n.25-26, p.3331-3346, 2001. · Segales, J. Manual casos de patologia porcina.Novartis AH, 2000 · Siegrist, C.A.; Córdova, M.; Brandt, C; Barrios, C.; Benrney, M.; Toughne, C.; Kovarik, J; Lamber, P. Determinants of infant responses to vaccines in presence of maternal antibodies. Vaccine, v.16, n.14-15, p.1409-1414, 1998. · Suradhat, S.; Buranapradikum, S.; Damronguamporins, S. The kinetics of citokines production and CD25 expression and porcine Lymphocities subpoblations following exposure to swine fever virus. Veterinary immunology immunopathology, v.106, p.197-208, 2005. · Thacker, B.; Wengher, M.; Eraldson, K.; Maxwell, K.; Thompson, J.; Thacker, E. Influencia de los anticuerpos maternales a la aplicación de una dosis de vacuna contra Mycoplasma hyopneumoniae. Pig veterinary international, v.2, p.307, 2002. · Thacker, E.L.; Thacker, B.J.; Boettcher, T.B. et al. Comparison of antibody production, lymphocyte stimulation and protection induced by four commercial Mycoplasma hyopneumoniae bacterins. Swine Health and Production, v.6, n.3, p.107-112, 1998. · Tortora, G.; Grabonski, S. Principles of anatomy and phisiology. NY: Harper Collins. 8th edition. v.8, p.103-213-551, 1996. · Tully, D.; Weipur, W.D.; Rose, J.P.; Pentzer, H.; Oyazu, D.; Mandelco, L.; Schert, J.; Lawrence, T.G.; Wose, R. A Phylogenetic Analysis of the Mycoplasmas: Basis for their classification. Journal of Bacteriology, v.171, n.12, p.6455-64-67, 1989. · Willson, P.J.; Rossi-Campos, A.; Potter, A.A. Tissue reaction and immunity in swine immunized with Actinobacillus pleuropneumoniae vaccines. Canadian Journal of Veterinary Research, v.59, p.299-305, 1995.
Salazar, J.J.; Loaiza Úsuga, P. Catabolismo de los anticuerpos maternales y duración de la inmunidad vacunal de las bacterinas contra (Mycoplasma hyopneumoniae) en cerdos. Veterinaria y Zootecnia, v.8, n.1, p.48-65, 2014.
< http://200.21.104.25/vetzootec/index.php?option=com_content&view=article&id=112> |